现有以下物质:
①NaCl固体 ②盐酸 ③Ba(OH)2溶液 ④铜 ⑤二氧化碳气体 ⑥硫酸氢钾固体
⑦乙醇(C2H5OH) ⑧液态硫酸 ⑨熔融态BaSO4 ⑩液态SO3
请回答下列问题(用序号):
以上物质中属于化合物的是 (填序号,下同),属于盐的是 ,属于氧化物的是 ,能导电的是_______________________,属于电解质的是______________________,属于非电解质的是___________________。
在恒温下,容积为2L的密闭容器中加人1mol N2和X mol H2,发生反应:N2(g)+3H2(g) 2NH3(g),50秒后达到平衡,测得反应放出的热量为18.4 kJ,c(NH3)=0.2mol/L,总物质的量为3.6mol.
2NH3(g),50秒后达到平衡,测得反应放出的热量为18.4 kJ,c(NH3)=0.2mol/L,总物质的量为3.6mol.
(1)该反应的ΔH= kJ·mol-1
(2)该条件下此反应的化学平衡常数的表达式K=________________温度升高,则K值________。(填“变大”、“变小”或“不变”).
(3)起始时充入的H2的物质的量X为_____,从反应开始到平衡,用H2的浓度变化表示的反应速率为:_____________。
(4)若起始时加入N2 、H2 、NH3的物质的量分别为a、b、c,达到平衡时各组分的物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是________________.
②若c=2 mol,在相同条件下达到平衡时,该反应吸收的热量为____________kJ.
对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
CH4 (g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-570 kJ·mol-1
CH4(g)+4NO(g)==="2" N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
请写出CH4与NO2生成无毒气体的热化学方程式:___________________________________________。
反应m A+n B p C+q D在某温度下达到平衡。
p C+q D在某温度下达到平衡。
①若A、B、C、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.8倍,则m、n、p ,q的关系是_____________。
②若A、B、C、D都为气体,且m+ n =" p+" q,则将气体体积压缩后A的物质的量将_________(填“减小”“增大”“不变”),平衡必定______移动。(填“正向”或“逆向”或“不”)
③若给体系升温, B的物质的量减少,则正反应为 ________反应(填“放热”“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态
⑤若加正催化剂,则反应物的转化率将________(填“减小”“增大”“不变”)
(每空2分,共12分)
(1)①相同温度下,相同物质的量浓度的Pb(NO3)2溶液的导电性远远大于(CH3COO)2Pb溶液的导电性,写出(CH3COO)2Pb的电离方程式:______________________________________________
②写出的CH3COONH4电离方程式
(2)取稀氨水进行下列操作,则NH3·H2O、NH4+、OH- H+ 浓度如何变化?
①通适量HCl气体时,c(NH3·H2O) ___________。(填写“增大”“减小”“不变”。下同)
②加入少量NaOH固体时,c(NH4+)___________。
③加入NH4Cl晶体时,c(OH-) _______ 。
④加入水时,c(H+) ____________
下图是中学化学的一个重要定量实验过程示意图,回答下列问题: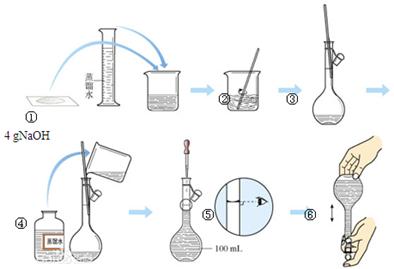
(1)该实验中的一处错误是 。
(2)该实验中,能较精确确定液体体积的两种玻璃仪器是 、 。
(3)操作过程中多次用到玻璃棒,请分别说明它们在实验中的作用:操作②中 、操作③中 。
(4)不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响(填“偏大”、“偏小”或“无影响”)。
a.在第②步操作中,有少量液体溅出烧杯外: 。
b.在第③步操作中,容量瓶内本来有少量水: 。
c.在第⑤步操作中,若俯视刻度线: 。
d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线: 。
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请填写标签上的内容(如图) 。
现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—。现取3份100 mL该溶液分别进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到标准状况下20.16 L气体;
第三份加入足量BaCl2溶液后,经过滤、洗涤、干燥、得到白色沉淀,再将沉淀经足量盐酸洗涤,发现沉淀部分溶解。
根据上述实验,试回答下列问题:
(1)由第一份进行的实验对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);
(2)由第二份进行的实验得知该混合物中应含有 (填离子符号),其物质的量浓度为 ;
(3)第三份实验中最终得到的沉淀成分为 ;(填化学式)
(4)综合上述实验,你认为以下结论正确的是 。
| A.该混合液中一定含NH4+、CO32—、SO42—、K+,可能含Cl— |
| B.该混合液中一定含NH4+、CO32—、SO42—,可能含K+、Cl— |
| C.该混合液中一定含NH4+、CO32—、SO42—,可能含Mg2+、K+、Cl— |
| D.该混合液中一定含NH4+、SO42—,可能含Mg2+、K+、Cl— |
(15分)资源化利用CO2不仅可以减少温室气体的排放,还可以重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式为:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ/mol,该反应中每生成1mol Fe3O4,转移电子的数目为 。
(2)在一定条件下,二氧化碳转化为甲烷的反应为:CO2(g)+4H2(g)  CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol/L, H2 0.8 mol/L, CH4 0.8 mol/L, H2O 1.6 mol/L。起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1mol CO2和4molH2,在Ⅱ中充入1mol CH4和2molH2O(g),300℃开始反应,达到平衡时,下列说法正确的是( )(填字母)。
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅱ中反应的平衡常数相同 |
| C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如下图所示:
①上述生产过程的能量转化方式是 、 。
②上述电解反应在温度小于900℃时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极电极反应式为 ,阴极电极反应式为 。
(10分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为: H2SO4=H++HSO4-,HSO4- H++SO42-。.
H++SO42-。.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)。
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 |
| B.c(SO42-)+c(HSO4-)=2c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) |
| D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>”“=”或“<”),原因是 。
(6分)(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用同样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为 。
(2)NO2可用氨水吸收生产硝酸铵,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液中滴加bL氨水后溶液显中性,则滴加氨水的过程中水的电离平衡将会 (填“正向”、“逆向”或“不”) 移动,所滴加氨水的浓度为 mol/L。(已知氨水的电离平衡常数Kb=2×10-5)
(5分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸: 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1? (选填“是”或“否”)。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
①c(Na+)-c(A-)= mol·L-1;
②c(OH-)-c(HA)= mol·L-1。
(4分)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? (填“是”或“否”),理由是 。
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有 。(多选)
A.NaOH
B.氨水
C.Cu2(OH)2CO3
D.Na2CO3
E.CuO
F.Cu(OH)2
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
据此回答下列问题:
(1)该硫酸的物质的量浓度为 mol/L。
(2)配制250mL 0.92mol·L-1的稀硫酸需取该硫酸 mL。
(3)配制时必需的玻璃仪器有:
(4)定容时,若加入的水超过刻度线,必须采取的措施是
(5)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯: ;
②容量瓶用水洗净后未烘干: ;
③定容时俯视容量瓶的刻度线: 。
(6)在配置过程中,下列操作不正确的是(填序号) 。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解. |
| D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(1)在60g 碳中含有的质子总数为 ;a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为 。
(2)7.8g Na2R含有0.2mol Na+,则Na2R的摩尔质量为 ;含有R的质量为1.6g 的Na2R的物质的量为 。
(3)标准状况下,3.4g NH3的体积为 ;它与标准状况下 LH2S含有相同数目的氢原子。