(1)在标准状况下,测得1.32 g某气体的体积为0.672 L。则此气体的摩尔质量为。
(2)等质量CO、CO2两种气体的的摩尔质量之比为;同温同压下的体积比为;其中氧元素的原子个数比为。
(3)常用食醋除去水壶中的水垢,以氢氧化镁为例,表明反应原理(用离子方程式表示)。
3 对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: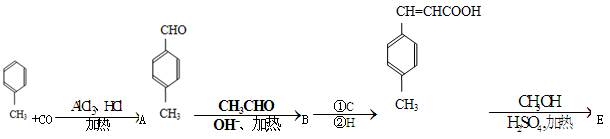
已知:HCHO+CH3CHO CH2=CHCHO+H2O。
CH2=CHCHO+H2O。
(1)遇FeCl3溶液显紫色的A的同分异构体有_______种。B中含氧官能团的名称为_____________。
(2)1molB最多能跟______molH2发生加成反应。
(3)试剂C可选用下列中的_____________。
a、溴水 b、银氨溶液 c、酸性KMnO4溶液 d、新制Cu(OH)2悬浊液
(4) 是E一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________________。
是E一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________________。
(5)E在一定条件下可以生成高聚物F,F的结构简式为_____________________________。
已知2A2(g)+B2(g) 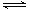 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将_____(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3kJ,C3浓度(填>、=、<)w mol·L-1,Q1、Q2、Q3之间满足何种关系
(4)能说明该反应已经达到平衡状态的是。
a.v(C3)="2" v (B2); b.容器内压强保持不变
c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
(5)改变某一条件,得到如图的变化规律
(图中T表示温度,n表示物质的量),可得出的结论正确的是;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2Q4(填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号)。
a.选择适当的催化剂b.增大压强
c.及时分离生成的C3d.升高温度
(12分)N2(g)+3H2(g) 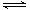 2NH3(g)反应过程的能量变化如下图所示。
2NH3(g)反应过程的能量变化如下图所示。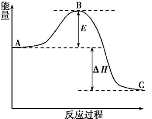
已知生成1 mol NH3(g)的ΔH=-46 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示、;若该反应使用催化剂,会使图中B点升高还是降低?。
(2)图中ΔH=kJ·mol-1。
(3)已知恒容时,该体系中各物质浓度随时间变化的曲线如图所示。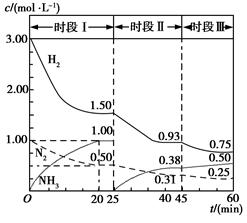
①在0.5 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②45 min时采取的措施是_______________________。
③比较I、II、III时段的化学平衡常数(分别用K1、K2、K3表示)大小________。
(6分)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,对氢气的相对密度是________。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g。 |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
(3)试确定K+是否存在?________,判断的理由是______________________________
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为 __KClO3+__HCl(浓)——__KCl+__ClO2↑+___Cl2↑+___H2O
(1)配平上述化学方程式并用双线桥标出电子转移的方向和数目。
(2)氧化剂是________,还原剂是________;氧化产物是________,还原产物是________。
(3)浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)产生0.1mol Cl2,则转移的电子的物质的量为________mol。
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂_______,离子方程式:____________________________________。
(2)CO2(HCl)试剂___________,离子方程式:__________________________________。
(3)O2(CO2)试剂__________,离子方程式:____________________________________。
(4)SO42-(CO32-)试剂_______,离子方程式:__________________________________。
(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化,则: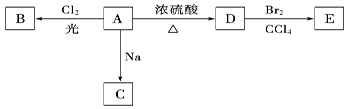
①A分子中的官能团名称是____________________;
②A只有一种一氯取代物,写出由A转化为B的化学方程式__________________________________________________________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是_______________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)_______________________。
①加成反应 ②加聚反应 ③氧化反应 ④水解反应
已知“HQ”的一硝基取代物只有一种,“HQ”的结构简式是_______________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式是_____________。
有4种无色液态物质:己烯、己烷、苯和甲苯,符合下列各题要求的分别是:
(1)不能与溴水或酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是,生成的有机物名称是,此反应属于反应。
(2)不能与溴水或酸性KMnO4溶液反应的是。
(3)能与溴水或酸性KMnO4溶液反应的是。
(4)不与溴水反应但与酸性KMnO4溶液反应的是。
有A、B、C、D 4种烃,各取0.01 mol充分燃烧后,B、C、D所产生的二氧化碳均为448 mL(标准状况);A燃烧所得的二氧化碳是其他三者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,B可以转变为C或D,C可以转变为D;B或C都能使酸性高锰酸钾溶液褪色,而A、D无此性质;在FeBr3存在时,A与液溴发生取代反应。
试推断出4种烃的结构简式:
(1)A是,B是,C是,D是。
(2)B→D的反应方程式:。
(3)除去D中C的反应方程式:。
(4)C发生加聚反应的方程式:。
(1)有机物CH3CH3、CH3CH=CH2、CH3CH2C≡CH、CH2=CH2、CH≡CH、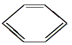 、CH3CH2OH中,与甲烷互为同系物的是__________,分子空间构型为平面形的是,直线形的是。
、CH3CH2OH中,与甲烷互为同系物的是__________,分子空间构型为平面形的是,直线形的是。
(2)在下列物质中,互为同分异构体的有________;互为同系物的有________;同为一种物质的有________。(分别用物质的序号填空)
按要求回答下列问题:
(1) 的系统命名为;
的系统命名为;
(2)3甲基2戊烯的结构简式为;
(3) 的分子式为;
的分子式为;
(4)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。
①试写出它的一种链式结构的同分异构体的结构简式_______________________。
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为________________________形。
实验室制欲用固体NaOH来配0.5mol/L的NaOH溶液500mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_________。
(4)在配制过程中,若其它操作均正确,下列操作会引起结果偏高的是
| A.没有洗涤烧杯和玻璃棒 |
| B.未等NaOH溶液冷却至室温就转移到容量瓶中 |
| C.容量瓶不干燥,含有少量蒸馏水 |
| D.定容时俯视标线 |
E、称量时间过长
阅读、分析下列两个材料:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
根据上述材料,回答下列问题____(填写序号):
A、蒸馏法B、萃取法
C、“溶解、结晶、过滤”的方法 D、分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用_______。
(2)将乙二醇和丙三醇相互分离的最佳方法是__________。
(3)用CCl4提取溴水中的溴单质的最佳方法是_________.
(4)分离汽油和水的最佳方法是___________