根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧Al
(1)只含有离子键的是(用序号回答,下同)
(2)含有共价键的离子化合物是
(3)属于共价化合物的是
(4)熔融状态能导电的化合物是
(5)熔融状态时和固态时,都能导电的是
(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)  2NO2 (g) △H > 0,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
2NO2 (g) △H > 0,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。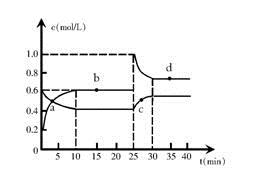
(1)该温度时,该反应的平衡常数为。
(2)a、b、c、d四个点中,化学反应处于平衡状态的是点。
(3)25 min时,增加了mol(填物质的化学式)使平衡发生了移动。
(4)d点对应NO2的物质的量浓度(填“>”、“<”或“=”)0.8 mol·L–1,理由是。
(一)双氧水和水都可看成是极弱的电解质,但H2O2与H2O相比,H2O2显弱酸性。
(1)若把H2O2看成二元弱酸,试写出它在水中的电离方程式 。
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为。
(二)下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a1×10-14(填“<”、“>”或“=”),由此判断的理由是:。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的C(OH-)为:。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =。
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg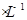 。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价):
。现用氯氧化法处理,发生如下反应(其中N均为一3价、O均为-2价): 该反应中,被氧化的元素是___________.
该反应中,被氧化的元素是___________.
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移方向和数目: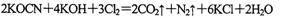
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯___________g.
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是___________.
a.NH3b.HI c.SO2d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中—种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________.(已知:氯元素最高化合价为+7价)
已知A和B两只试管的溶液中含有K+、Ag+、Mg2+、Cl-、NO3-、OH-六种离子,向A试管中滴加酚酞溶液呈红色。请回答下列问题:
(1)A试管的溶液中含有上述离子有__________;若向A溶液中加入铝片写出该化学反应的离子方程式____________________ ;
(2)向某试管中滴加稀盐酸产生白色沉淀,则该试管为____________(填A或B);
(3)若向B试管中加入合适的药品,过滤后可以得相应的金属和只含一种溶质的溶液,写出反应的离子方程式:;
(4)若将试管A和试管B的溶液按一定的体积比混合过滤后,蒸干可得到—种纯净物,则混合过程中发生反应的离子方程式______________、___________;
(5)若向试管A的溶液中的阳离子组成的碳酸氢盐溶液中,分别滴加盐酸和少量Ba(OH)2,则反应的离子方程式分别为_______________、________________.
某工厂的工业废水中含有大量的Fe2+、SO42-和较多的Cu2+及少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
(1)操作②的名称为__________,所需要的玻璃仪器为__________、__________、烧杯。
(2)试剂⑤的化学式为__________,发生化学反应的离子方程式为__________。
(3)为验证溶液⑧中含有SO42-:取少量的溶液⑥于试管中,先加入____再加入__________,若观察到有白色沉淀,则说明溶液⑧中含有SO42-。写出上述反应的离子方程式______________________________.
Ⅰ.氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2 Si3N4+6CO;DH <0。
Si3N4+6CO;DH <0。
(1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如图所示,
②和③分别仅改变一种反应条件。所改变的条件分别是:②;③。
(2)1 000℃时,在2 L密闭容器中进行上述反应,若起始时N2浓度为4.0 mol/L,经1小时反应达到平衡状态,此时容器内气体总浓度为10.0 mol/L,则以CO表示的反应速率为。
Ⅱ.图为Mg—NaClO燃料电池结构示意图。
已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极。
(1)Y电极材料为。
(2)X电极发生的电极反应式为。
(3)若该电池开始时加入1L 0.2mol/L的NaOH溶液,然后从下口充入1L 0.1mol/L的NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的pH=。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| IA |
0 |
|||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的离子半径由大到小的顺序是(写离子符号)。
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是________________(写化学式)。
(3)④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其电子式:_____________。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
则X溶液与Y溶液反应的离子方程式为_______________________________。
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
(1)试剂A是;
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法:Al2O3 +C+N2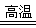 AlN+CO(配平)
AlN+CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
(1)某恒温恒容容条件下的可逆反应: △H<O,起始充入amol N2、bmol H2,达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 moL,回答下列问题:
△H<O,起始充入amol N2、bmol H2,达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 moL,回答下列问题:
①a=___________,b=___________。
②平衡后,再充入5 mol NH3,化学平衡将向__________移动(填“左”或“右”或“不移动”),再达新平衡时N2的百分含量_______(填“>”、“<”、“=”)原平衡时N2的百分含量;
③平衡后若升高温度,则平衡向________(填“向左”或“向右”)方向移动;若增加压强,则平衡向________(填“向左”或“向右”)方向移动。
(2)某恒温恒压条件下的可逆反应: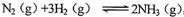 ,起始充入1 mol N2、
,起始充入1 mol N2、
3 molH2、16 mol NH3,容器的容积为VL。达到平衡后,N2、H2、NH3的物质的量分别为amol、b mol、cmol,此时容器的容积为.1VL,回答下列问题:
①起始时反应速率v(正)____(填“>”、“<”、“=”)v(逆)。
②平衡时a=________,b=_______。
③若平衡后再充入3.6 mol NH3,重新建立平衡时容器的容积为_____________L。
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知: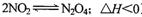 )
)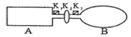
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)________(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将 ________(填“增大”、“减小”、“不变”)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,N02的转化率将________(填“增大”、“减小”、“不变”);若通入等量的Ne气,则达到平衡时,A中的NO2转化率________ ,B中的NO2转化率将________(填“增大”、“减小”、“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,_____________________中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时的N2O4物质的量为_______________。
高温下,炼铁高炉中存在下列平衡: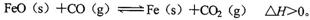
回答下列问题:
(1)写出该反应的平衡常数表达式_______________________________________。
(2)升高温度,该反应的平衡常数K值将__________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将__________(填“增大”、“减小”、“不变”)。
(3)已知11OO℃时该反应的平衡常数K=0.263。在1100℃时,测得高炉中。 此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值 __________(填”>”、“<”、“=”)0.263。
800℃时,在2L密闭容器内充入0.50 mol NO和0.25 mol O2,发生如下反应: 。体系中,n(NO)随时间的变化如表:
。体系中,n(NO)随时间的变化如表:
(1)能说明该反应已达到平衡状态的____________。
A.V(NO2)正="V" (O2)逆B.容器内压强保持不变
C.V(NO)逆="2v" (O2)正 D.容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___________。
A.适当升高温度 B.缩小反应容器的体积
C.增大O2的浓度D.选择高效催化剂
(3)前2s内氧气的消耗速率为__________。
可逆反应 ,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B转化率___________,v(正) ___________,v(逆)___________。
(2)使用催化剂,A的物质的量___________,若v(正)增大,则v(逆)____________。
(3)保持温度和压强不变加入稀有气体,则C的物质的量___________,A的转化率___________。
(4)保持温度和体积不变加入稀有气体,则A的转化率___________,v(正)_____________。
(5)若温度和体积不变,反应从正反应开始至平衡,在这个变化过程中,容器内气体的密度___________,压强___________。