被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: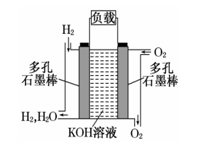
(1)写出氢氧燃料电池工作时负极反应方程式:
负极: 。
(2)为了获得氢 气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O 反应生成 H2 和 CO 的化学方程式:
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 : 电池总离子反应方程式为 。
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、 O 三种元素,常用作有机合成的中间体。16.8 g 该有机物经燃烧生成 44.0 g CO2 和 14.4 g H2O ;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O—H 键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为 6:1:1。A 的分子式是 A的结构简式是
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。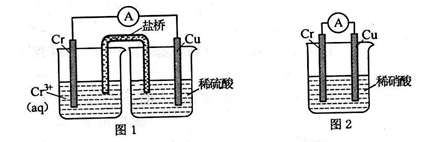
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。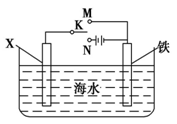
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变b.气体的密度不随时间改变
c.c(A)不随时问改变d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。
(2)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应H2(g)+ Cl2(g)=2HCl (g) 的△H = 。
(3)已知:CO(g) + 1/2O2(g) = CO2(g) △H = -283.0 kJ/mol
CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H = -726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
(4)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为 ;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 。
回答下问题:
(1)下列说法不正确的是______________(填字母序号)。
| A.铝的氧化物属于碱性氧化物 |
| B.光纤制品的基本原料为SiO2 |
| C.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 |
| D.液氨、液氯、液态氯化氢都是非电解质 |
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)出土的青铜器大多受到魂晶腐蚀,某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为______________。采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为____________。
(3)KNO3中NO3-的空间构型为__________,写出与NO3-互为等电子体的另一种阴离子的化学式:__________。
(4)已知配合物CrCl3·6H2O中心原子Cr3+配位数为6,向含0.1molCrCl3·6H2O的溶液中滴加2mol/LAgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则该配离子的化学式为________。
(1)常说的三大合成材料包括塑料、____________和_____________。
(2)某些废弃的塑料通过分类、清洗、再加热熔融,可重新成为制品,这类塑料属于_________(填“热塑性”或“热固性”)塑料。
(3)CO中毒是因为CO与血红蛋白结合的能力远远大于_________(填一种气体名称)与血红蛋白结合的能力,导致人窒息。
(4)下列属于塑料制品的是_________(填序号),属于合成纤维的是_________(填序号)
A聚乙烯制品 B汽车轮胎 C玻璃钢 D涤纶 E羊毛
(5)较多量的轻金属盐如饱和的Na2SO4溶液可使蛋白质产生__________(填“盐析”或“变性”)
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12Lb.>1.12Lc.<1.12L
近来,制备和利用氢气这一清洁能源已有多项成果。
(1)德国克莱斯公司成功研制了甲醇(CH3OH)制氢车载燃料电池工艺,其原理如下流程图所示:
①流程图中,甲醇与水在选择氧化器中反应生成二氧化碳和氢气,写出该反应的化学方程式
②该车载燃料电池的介质为碱性环境,请写出该燃料电池的正极反应式为
(2)美国Bay等工厂成功研制了以甲烷来制取氢气,其生产流程如下图:
①此流程的第Ⅱ步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式K=
H2(g)+CO2(g),该反应的化学平衡常数表达式K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如下表,在830 ℃、以表中的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
| 实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
③若400 ℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2kJ,第Ⅰ步反应的热化学方程式为:CH4(g) + H2O(g) === 3H2(g) + CO(g) ΔH=-103.3 kJ·mol-1则400 ℃时,甲烷和水蒸反应生成二氧化碳和氢气的热化学方程式为:
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,下图是三种催化剂在光照分解水实验中的效果比较图。
要得出如图所示的实验结果,需要测定的实验数据是 ,本实验的目的是 。
(1) 图中A为直流电源,B为浸透饱和氯化钠和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。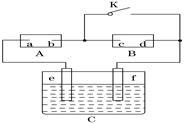
①电源A中a点为________极。
②滤纸B上发生的总反应的离子方程式为 。
③欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电镀槽中盛放的电镀液可以是________或________。
(2)加碘盐中的KIO3也可以用电化学氧化法制取:电解KI溶液可以制取KIO3。则电解时阳极材料可选用 (填“石墨”或“铜”)。写出该电极反应方程式
2015年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)△H =-867kJ·mol-1
2NO2(g)  N2O4(g) △H =-56.9kJ·mol-1
N2O4(g) △H =-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。
写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a)。
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH) 2 |
Cu(OH) 2 |
Fe(OH) 2 |
Fe(OH) 3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是_________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
(1)某烯烃,经与氢气加成反应可得到结构简式为
的烷烃,则此烯烃可能的结构简式是:___________、___________、___________。
(2)有A、B、C、D、E 5种烃,各取0.01 mol充分燃烧后,B、C、E所产生的二氧化碳均为448 mL(标准状况);A或D燃烧所得的二氧化碳都是前者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,其中A 可以转化为D,B可以转变为C或E,C可以转变为E;B或C都能使高锰酸钾酸性溶液褪色,而A、D、E无此性质;在铁屑存在时A与溴发生取代反应。
①写出烃的结构简式:B是___________, C是___________,D是___________, E是___________。
②写出A与溴反应方程式______________________________
将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况下)。
(1)写出上述过程中,有关反应的离子方程式______________、_____________。
(2)完成该反应至少需要量取10mol/L的浓硝酸__________mL。
(3)混合气体中NO2的体积为__________L,NO的体积为__________L(均为标准状况下)。
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____________mol。
已知实验室制取Cl2的反应为:MnO2+4HCl(浓)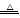 MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为
(2)已知硫酸铅不溶于水,铅蓄电池的工作原理为Pb+PbO2 +2H2SO4 =2PbSO4+2H20,写出该反应的离子方程式 ;溶液中硫酸根离子检验的方法为 。
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4 +2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S 溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
(1)请写出上述反应方程式: ;它的基本反应类型是 。
(2)若安全气囊内含有195gNaN3,其物质的量为 。
(3)若195gNaN3完全分解,在标准状况下,气囊膨胀的体积约为 。
(4)28gKOH固体必须溶解在 g水中,才能使每200个水分子中有1个K+。
(5)Mg能在O2、N2、CO2中燃烧,写出镁在CO2中燃烧的化学方程式 。