(14分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol•L-1•min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示:lg5 =0.7)
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是_______________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5 (g)  4NO2(g) + O2 (g) + Q (Q < 0 )
4NO2(g) + O2 (g) + Q (Q < 0 )
①反应达到平衡后,若再通入一定量N2,则N2O5的转化率将________(填“增大”、“减小”或“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_____________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2______T1(填“>”、“<”或“=”)
(3)如图所示装置可用于制备N2O5,
则N2O5在电解池的_______区生成,
其电极反应式为_______________________。
将一定量的SO2和含0.7mol的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2 (g) + O2(g)  2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
(1)判断该反应达到平衡状态的标志是______________。
A.SO2和SO3浓度相等
B.SO2的百分含量保持不变
C.SO3的生成速率与SO2的消耗速率相等
D.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是_____________。
A. 向装置内再充入N2 B. 向装置内再充入O2
C. 改变反应的催化剂 D. 升高温度
(3)求该反应达到平衡时SO2的转化率
(4)若将平衡混合气体的5 %通入过量的BaCl2溶液,生成沉淀多少克?
设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气充分煅烧:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
(1)所得气体中SO2的体积分数不超过________%(保留一位小数)。
(2)在实际生产中,接触室SO2与O2的体积比以1:4较为适合。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5 m3/ s,则再往接触室里通入的空气的流速应该为___________m3 / s(保留一位小数,气体体积在同温同压下测定)。
(3)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20: x,则x=_______,此时反应中SO2的转化率为__________%(保留一位小数)。
(4)硫酸厂常用氨水吸收尾气的SO2、SO3等,再向吸收液中加入浓硫酸,以制取高浓度的SO2和(NH4)2SO4、NH4HSO4固体。为了测定上述(NH4)2SO4、NH4HSO4固体混合物的组成,现称取该样品四份〔(NH4)2SO4和NH4HSO4的分解温度均高于200℃〕,实验数据如下:(气体均在标况下测定)
| 实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
| 1 |
3.62 |
50 |
0.896 |
| 2 |
7.24 |
50 |
1.792 |
| 3 |
10.86 |
50 |
2.016 |
| 4 |
14.48 |
50 |
1.568 |
①该混合物中(NH4)2SO4和NH4HSO4的物质的量之比____________
②所用NaOH溶液的物质的量浓度____________。
元素A---D是元素周期表中短周期的四种元素,据表中信息回答:
| A |
单质是热和电的良导体,熔点97.81℃,沸点882.9℃,在O2中燃烧得到淡黄色固体 |
| B |
原子核外有7种运动状态不同的电子 |
| C |
单质在常温常压下是气体,原子的L层有一个未成对的P电子 |
| D |
+2价阳离子的核外电子排布与氖原子相同 |
(1)B元素原子的最外层轨道表示式是____________________,D离子的核外电子排布式是__________________,C和D形成的化合物的电子式为_______________。
(2)A、B、C、D的原子半径由大到小顺序______________________(用元素符号表示)
(3)D单质在B单质中燃烧的化学方程式______________________________。
(4)A和D两元素金属性较强的是_________(用元素符号表示)。写出能证明该结论的一个实验事实______________________________________。
A、B、M、X、Y、Z是短周期元素,且原子序数依次增大,已知它们的部分化合物的性质如下:
| A的氢化物 |
B的氢化物 |
M的氢化物 |
X的氧化物 |
Y的氢化物分子构型 |
Z的最高价氧化物 |
| 含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
正四面体 |
对应水化物为最强酸 |
(1)M原子核外电子占据的轨道有________个,B的氢化物的电子式__________。
(2)M、X、Z三种元素简单离子的半径由大到小的顺序____________________(用离子符号和“>”表示)
(3)B的氢化物和Z的氢化物相遇时现象是____________________________。
(4)推测A和Y组成的化合物的熔点____________(填“高”或“低”),理由是________。
(5)A元素的氢化物有多种,1mol A的某种氢化物中含有14 mol电子,已知常温常压下1g该氢化物在足量氧气中充分燃烧生成液态水时放出热量为50 kJ,写出该反应的热化学方程式________________________________________。
某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填入以下空格内。
NF3 + _______ → HF + ______ + __________
(2)反应过程中,被氧化与被还原的元素的物质的量之比为___________;
(3)配平该反应的化学方程式,并标出电子转移的方向和数目;
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄露,还是易于发现。,你判断该气体泄漏时的现象是_____________________;一旦NF3泄漏,可以用溶液__________(填化学式)喷淋的方法减少污染。
用如下装置可以完成一系列实验(图中夹持装置已略去)。
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
④ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
| 现象 |
褪色 |
浅黄色 |
||
| 体现SO2的性质 |
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂为。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式。①处包有的某固体物质可能是。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:。
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。 M与其他物质的转化关系如下(部分产物已略去):
M与其他物质的转化关系如下(部分产物已略去):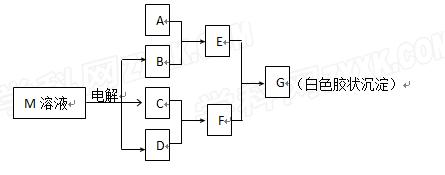
(1)工业电解M溶液的化学方程式为。
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是周期族,写出A与B溶液反应的化学方程式是。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为,写出E与F反应的离子方程式是。
(4)B的电子式为:__________,其中的化学键为:______________。
(5)说明M物质的一种用途:_________________。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,化学反应方程式。
⑵漂白粉的有效成分是(填化学式)。漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。
有以下几种物质①干燥的食盐晶体 ②液态氯化氢③水银④蔗糖⑤冰醋酸⑥KNO3溶液 ⑦SO3,填空回答:(填序号)
⑴以上物质中属于电解质的是
⑵以上物质中属于非电解质的是
⑶以上物质中加入水中与水充分混合后,水溶液能导电的是
有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
⑴依次写出甲、乙、丙三种元素的元素名称:甲、乙、丙
⑵画出甲的原子结构示意图和丙离子的结构示意图:甲、丙
⑴1mol H2SO4中含______mol个氧原子,个氢原子。
⑵4.5g水与________g硫酸所含的分子数相等,它们所含氧原子数之比是。
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,名不符实的一种物质是________。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时):
_____________;______________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________(填序号)
| A.Ag | B.Cu | C.Al | D.Fe |
(4)烧碱、纯碱溶液均可吸收CO2。向含有4.0gNaOH的溶液中通入CO2,当通入的CO2与溶液中NaOH物质的量之比为9:7时,则所得溶液中NaHCO3的质量为__ _g。(相对原子质量:H—1 C—12 O—16 Na—23)