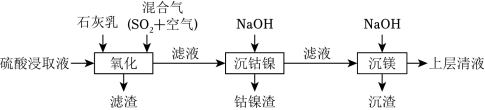
某工厂采用如图工艺处理镍钴矿硫酸浸取液(含 和 )。实现镍、钴、镁元素的回收。
已知:
|
物质 |
Fe(OH)3 |
Co(OH)2 |
Ni(OH)2 |
Mg(OH)2 |
|
Ksp |
10﹣37.4 |
10﹣14.7 |
10﹣14.7 |
10﹣10.8 |
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 __________(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ), 中过氧键的数目为__________。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为__________( 的电离第一步完全,第二步微弱);滤渣的成分为 、__________(填化学式)。
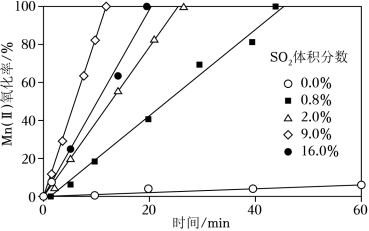
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如图。 体积分数为__________时, (Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是__________。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为__________。
(6)“沉镁”中为使 沉淀完全( ),需控制 不低于__________(精确至 )。
阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)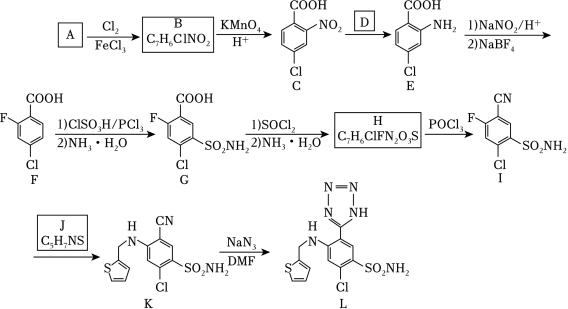
已知:R﹣COOH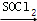 R﹣COCl
R﹣COCl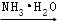 R﹣CONH2
R﹣CONH2
回答下列问题:
(1)A的化学名称是 。
(2)由A生成B的化学方程式为 。
(3)反应条件D应选择 (填标号)。
a.HNO3/H2SO4
b.Fe/HCl
c.NaOH/C2H5OH
d.AgNO3/NH3
(4)F中含氧官能团的名称是 。
(5)H生成I的反应类型为 。
(6)化合物J的结构简式为 。
(7)具有相同官能团的B的芳香同分异构体还有 种(不考虑立体异构,填标号)。
a.10
b.12
c.14
d.16
其中,核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构为 。
甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)═2O3(g)ㅤK1ㅤΔH1=285kJ•mol﹣1
②2CH4(g)+O2(g)═2CH3OH(l)ㅤK2ㅤΔH2=﹣329kJ•mol﹣1
反应③CH4(g)+O3(g)═CH3OH(l)+O2(g)的ΔH3= kJ•mol﹣1,平衡常数K3= (用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应MO++CH4═M++CH3OH,结果如图所示。图中300K的曲线是 (填“a”或“b”)。300K、60s时MO+的转化率为 (列出算式)。
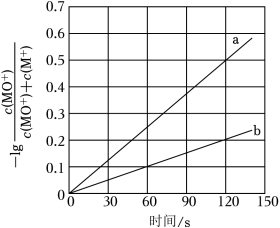
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如图所示(两者历程相似,图中以CH4示例)。
(i)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ii)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(iii)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。
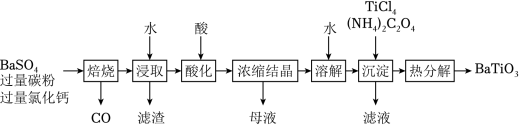
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是 。
(2)“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS。“浸取”时主要反应的离子方程式为 。
(3)“酸化”步骤应选用的酸是 (填标号)。
a.稀硫酸
b.浓硫酸
c.盐酸
d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?其原因是 。
(5)“沉淀”步骤中生成BaTiO(C2O4)2的化学方程式为 。
(6)“热分解”生成粉状钛酸钡,产生的 。
玻璃容器被下列物质沾污后,需要洗涤。如洗涤方法属于物理方法的,请写出所需试剂;洗涤原理属于化学反应的,写出有关反应的离子方程式;若无法用试剂使容器复原者,请说明原因。
(1)盛石灰水后的沾污:
(2)碘的沾污:
(3)硫的沾污:
(4)长期盛强碱溶液的试剂瓶变“毛”了。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: (两个);不采用铜跟浓硫酸反应来制取硫酸铜的原因是 (答两点)
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。
已知:光催化制氢:2H2O(l)==2H2(g)+O2(g) ΔH=+571.5 kJ/mol
H2与CO2耦合反应:3H2(g)+CO2(g)==CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol
则反应:2H2O(l)+CO2(g) ="=" CH3OH(l)+3/2O2(g)的ΔH= kJ/mol
你认为该方法需要解决的技术问题有 。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应(填“I”或“II”。下同)制甲醛的原子利用率更高 。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。(原子利用率表示目标产物的质量与生成物总质量之比。)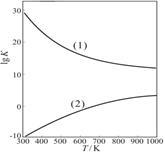
②右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示 (填“I”或“II”)的反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式:
(4)某溶液中发生反应:A 2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,在空气中煅烧冰铜时,产生一种有刺激性气味的气体A,该气体排放到空气中,是导致酸雨的形成的主要原因。
完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d.石灰乳
(2)已知铝在高温下能将某些金属从其氧化物中置换出来。将铝与泡铜发生反应从而得到粗铜。泡铜冶炼粗铜的化学方程式是 。每当有1mol铝参加反应,则转移电子个数为 ___
(3)SO2气体与氢氧化钠反应时,得到的盐为Na2SO3或 NaHSO3。通过计算回答:将0.3 mol SO2通入100mL含0.4 molNaOH溶液中,充分反应后得到的盐物质的量分别是多少?(写出计算过程)
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 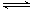 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。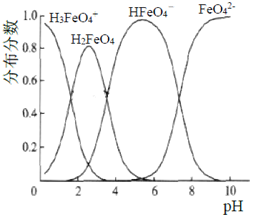
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-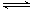 H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5B.10-6C.10-7D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
I.下图为相互串联的三个装置,试回答: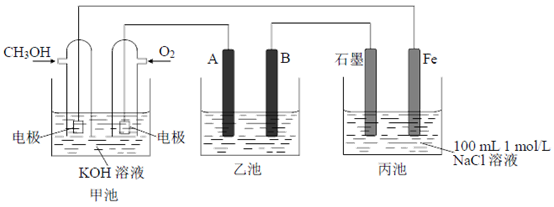
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
(Ⅰ)A、B、C、D、E五种溶液分别为NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol/L xLB溶液、0.001mol/L yLD溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是_____________溶液
(2)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是_____________(填写序号)
① ;②
;② ;③c(H+)和c(OH-)的乘积;④OH-的物质的量
;③c(H+)和c(OH-)的乘积;④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_____________曲线(填写序号).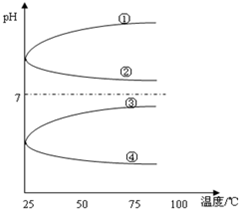
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_____________.
(Ⅱ)如下图所示 ,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。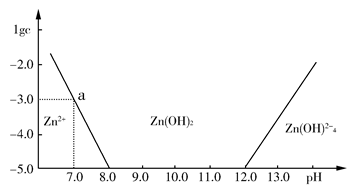
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:
完成下列填空:
(1).该反应化学平衡常数K的表达式为 ;
实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是 反应(填“吸热”或者“放热”)。
(2).上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: 。
(3).该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)= mol。
(4).对该反应达到平衡后,以下分析正确的是 (选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5).氯元素能形成多种离子。在水溶液中1molCl–、1mol ClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示) ;若有1.5molB发生反应,转移电子 mol。
【化学—选修2:化学与技术】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是 _____________(填两种物质的名称),其净水作用的原理是_________________________。
(2)水的净化与软化的区别是____________________________________。
(3)硬度为1的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_______________。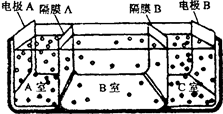
(4)若(3)中的天然水还含有c(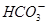 )=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
(5)如图是电渗析法淡化海水的原理图。其中,
电极A接直流电源的正极,电极B接直流电源的
负极。
①隔膜A是_________离子交换膜(填“阴”或
“阳”)。
②某种海水样品,经分析含有大量的Na+,Cl-,
以及少量的K+,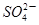 。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。
。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。
Ⅰ已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ•mol-1
②H2O(l)═H2O(g) △H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式: 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断⑴中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH) = 3v逆(H2) ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。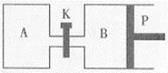
Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题: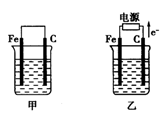
(1)若两池中均盛放CuSO4溶液,甲池中石墨棒上的电极反应式为____________________.
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.