将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
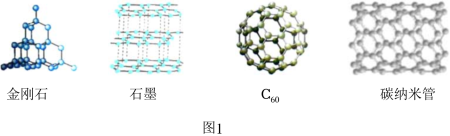
(1)图1所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
(2)酞菁和钴酞菁的分子结构如图2所示。
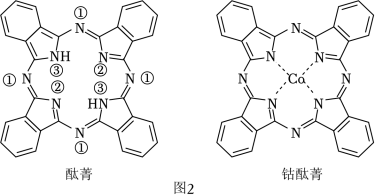
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对电子与钴离子形成 键。
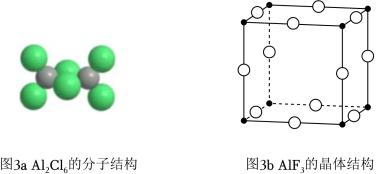
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 。AlF3的熔点为1090℃,远高于AlCl3的192℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图3b所示,F﹣的配位数为 。若晶胞参数为apm,晶体密度ρ= g•cm﹣3(列出计算式,阿伏加德罗常数的值为NA)。
铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为( ,还含有一定量的 和 )生产 的一种工艺流程如图。
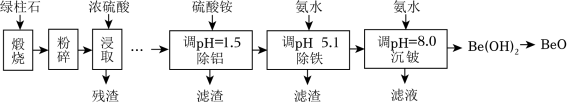
回答问题:
(1) 中 的化合价为_____。
(2)粉碎的目的是__________;残渣主要成分是_____(填化学式)。
(3)该流程中能循环使用的物质是_____(填化学式)。
(4)无水 可用作聚合反应的催化剂。 与足量 在 制备 的化学方程式为__________。
(5)沉铍时,将 从 提高到 ,则铍的损失降低至原来的_____ 。
在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:
(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化: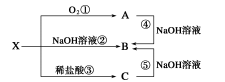
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
在2FeS04+ H202 +H2S04=Fe2(S04)3+2H20反应中,氧化剂是 ,还原剂是____;被氧化的元素是 ,被还原的元素是 。反应中若转移了0.3mol e,消耗H2 02物质的量为 。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: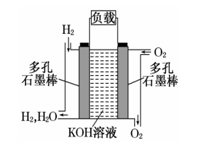
(1)写出氢氧燃料电池工作时负极反应方程式:
负极: 。
(2)为了获得氢 气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O 反应生成 H2 和 CO 的化学方程式:
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 : 电池总离子反应方程式为 。
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、 O 三种元素,常用作有机合成的中间体。16.8 g 该有机物经燃烧生成 44.0 g CO2 和 14.4 g H2O ;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O—H 键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为 6:1:1。A 的分子式是 A的结构简式是
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。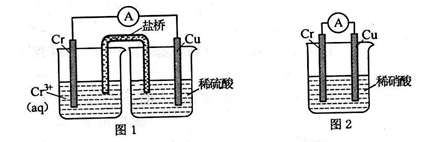
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。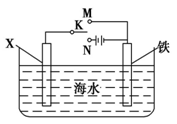
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示: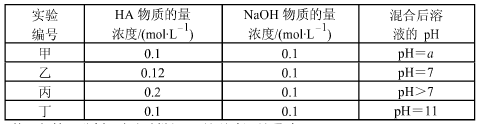
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?________________。
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系_____________。
A.前者大B.后者大C.两者相等D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:___________
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_______mol·L-1。
(5) 某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B===H++HB-HB- H++B2-
H++B2-
回答下列问题:
在 0.1 mol·L-1的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
(1)4g CO 在氧气中燃烧生成 CO2,放出 9.6kJ 热量,写出 CO 燃烧的热化学方程式;
(2)已知拆开 1mol H﹣H 键、1mol N﹣H 键、1mol N≡N 键分别需要的能量是 436kJ、391kJ、946kJ,则 N2与 H2反应生成 NH3的热化学方程式为 。
(3)已知碳的燃烧热△H1="a" kJ•mol﹣1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H2="b" kJ•mol﹣1
S(s)+2K(s)═K2S(s)△H3="c" kJ•mol﹣1
则 S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H= 。
II.稀土元素是宝贵的战略资源,赣州的稀土蕴藏量居世界首位,是名符其实的稀土王国。
(4)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下 CeCl3易发生水解,无水 CeCl3可用加热 CeCl3·6H2O 和 NH4Cl 固体混合物的方法来制备。其中 NH4Cl 的作用是
(5)在某强酸性混合稀土溶液中加入 H2O2,调节 pH≈3,Ce3+通过下列反应形成 Ce(OH)4沉淀得以分离。完成反应的离子方程式:□Ce3++□H2O2+□H2O ===□Ce(OH)4↓+□_________
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变b.气体的密度不随时间改变
c.c(A)不随时问改变d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
下表是不同温度下水的离子积的数据。试回答以下问题:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积 |
1×10-14 |
a |
1×10-12 |
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是 。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)在t2温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合:
①若所得混合液为中性,则a∶b=____________;
②若所得混合液pH=2,则a∶b=____________。
下列四个装置图均与电化学有关,请根据图示回答相关问题: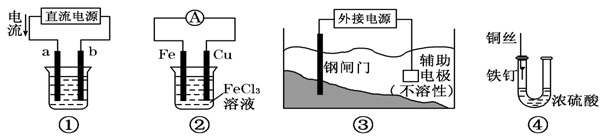
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。
(2)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应H2(g)+ Cl2(g)=2HCl (g) 的△H = 。
(3)已知:CO(g) + 1/2O2(g) = CO2(g) △H = -283.0 kJ/mol
CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H = -726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
(4)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为 ;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 。
材料是为人类社会所需要并能用于制造有用器物的物质。按用途可分为结构材料,功能
材料等;按化学组成和特性又可分成四类,请将下列物质的标号填在相应的空格中:
A水泥 B半导体材料C塑料 D超硬耐高温材料 E陶瓷
F普通合金 G合成橡胶合成纤维 H玻璃
(1)属于传统无机非金属材料的有______________________________;
(2)属于新型无机非金属材料的有______________________________;
(3)属于金属材料的有________________________________________。