(10分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为: H2SO4=H++HSO4-,HSO4- H++SO42-。.
H++SO42-。.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)。
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 |
| B.c(SO42-)+c(HSO4-)=2c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) |
| D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>”“=”或“<”),原因是 。




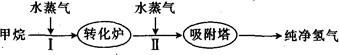
 CO(g)+3H2(g)。
CO(g)+3H2(g)。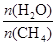 ]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。
]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号