江苏高邮市高一上学期期中调研测试化学试卷
水是生命之源。下列关于水的说法正确的是
| A.水属于非电解质 |
| B.氢氧两种元素只能组成水 |
| C.0℃时冰的密度比液态水的密度大 |
| D.标准状况下,18g水分子的物质的量为1mol |
小明体检的血液化验单中,葡萄糖为5.9×10-3 mol·L-1 。表示该体检指标的物理量是
| A.溶解度(s) | B.物质的量浓度(c) |
| C.质量分数(w) | D.摩尔质量(M) |
在日常生活中会接触到许多物质。下列物质中属于酸性氧化物的是
| A.硫酸铵 | B.水 | C.二氧化碳 | D.氧化铜 |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是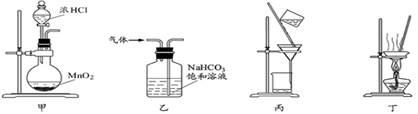
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
下列分散系中,能产生丁达尔效应的是
| A.硫酸铜溶液 | B.硫酸溶液 |
| C.氯化铁溶液 | D.氢氧化铝胶体 |
已知2H和3H都是制造氢弹的原料。下列关于2H和3H的说法正确的是
| A.2H和3H的质子数不同 | B.2H和3H互为同位素 |
| C.2H和3H是同一种核素 | D.3H原子的电子数为3 |
提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法是
| A.加入过量的K2CO3溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
| B.加入过量的K2SO4溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
| C.加入过量的Na2CO3溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
| D.加入过量的Na2SO4溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生氧化反应 | D.Cl2是还原剂 |
下列说法中不正确的是
| A.在非标准状况下,1 mol O2的体积也有可能是22.4 L |
| B.在温度和压强一定时,气态物质的体积主要由气体分子数目和分子的大小决定 |
| C.同温同压下,0.3 mol N2和0.7 mol O2的体积比为3∶7 |
| D.同温同压下,相同体积的任何气体所含有的分子数目一定相同 |
下列各组离子在溶液中能大量共存的是
| A.H+、Na+、HCO3-、Cl- | B.Cu2+、Na+、Cl-、SO42- |
| C.Mg2+、K+、SO42-、OH- | D.Ag+、Al3+、NO3-、Cl- |
下列四种化学实验操作名称从左到右分别是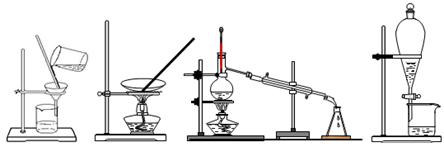
| A.过滤、蒸发、蒸馏、萃取 | B.过滤、蒸馏、蒸发、萃取 |
| C.蒸发、蒸馏、过滤、萃取 | D.萃取、蒸馏、蒸发、过滤 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列属于3区域的是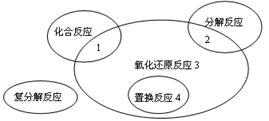
| A.Fe+CuSO4=FeSO4+Cu |
B.2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
下列电离方程式中,书写正确的是
| A.Na2SO4=2Na++SO4-2 | B.Ba(OH)2=Ba2++(OH-)2 |
| C.KClO3=K++Cl-+3O2- | D.Fe2(SO4)3=2Fe3++3SO42- |
下列溶液中Cl—的物质的量浓度与100 mL 2 mol·L-1 MgCl2溶液中Cl—的浓度相等的是
| A.150 mL 4 mol·L-1 NaCl溶液 |
| B.75 mL 1 mol ·L-1 AlCl3溶液 |
| C.75 mL 3 mol·L-1 CaCl2溶液 |
| D.200 mL 2 mol·L-1 KCl溶液 |
若某氖原子的质量是a g,一个12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
A.该氖原子的相对原子质量可以表示为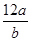 |
| B.该氖原子的相对原子质量可以表示为aNA |
C.W g该氖原子的物质的量一定是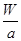 mol mol |
| D.12b=NA |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.氯水的颜色呈浅绿色,说明氯水中含有Cl2 |
| B.向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是
| A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B.0.1 mol H2O中含有电子的数目为NA |
| C.标准状况下,11.2 L四氯化碳中含有分子的数目为0.5NA |
| D.0.5 mol ·L-1 CaCl2溶液中的Cl—的数目为NA |
科学的实验方法为我们探索物质世界提供了一把金钥匙。下列实验方法正确的是
| A.实验室可通过蒸馏的方法,从含Fe3+的自来水中获得少量纯净水 |
| B.向样品中加入盐酸酸化的氯化钡溶液,以确定样品中是否含有SO42- |
| C.用洁净的玻璃棒蘸取待测液样品溶液置于酒精灯火焰上灼烧,检测是否含有Na+ |
| D.用干燥且洁净的玻璃棒蘸取待测溶液滴在湿润的pH试纸中部,跟标准比色卡对照可测定溶液的pH值 |
在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是
| A.11.2 g | B.25.2 g | C.16.8 g | D.33.6 g |
现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—。现取3份100 mL该溶液分别进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到标准状况下20.16 L气体;
第三份加入足量BaCl2溶液后,经过滤、洗涤、干燥、得到白色沉淀,再将沉淀经足量盐酸洗涤,发现沉淀部分溶解。
根据上述实验,试回答下列问题:
(1)由第一份进行的实验对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);
(2)由第二份进行的实验得知该混合物中应含有 (填离子符号),其物质的量浓度为 ;
(3)第三份实验中最终得到的沉淀成分为 ;(填化学式)
(4)综合上述实验,你认为以下结论正确的是 。
| A.该混合液中一定含NH4+、CO32—、SO42—、K+,可能含Cl— |
| B.该混合液中一定含NH4+、CO32—、SO42—,可能含K+、Cl— |
| C.该混合液中一定含NH4+、CO32—、SO42—,可能含Mg2+、K+、Cl— |
| D.该混合液中一定含NH4+、SO42—,可能含Mg2+、K+、Cl— |
下图是中学化学的一个重要定量实验过程示意图,回答下列问题: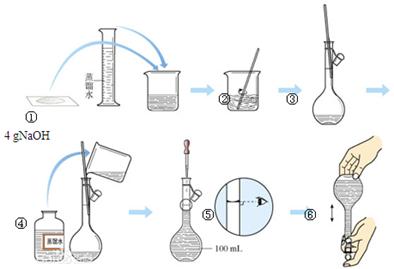
(1)该实验中的一处错误是 。
(2)该实验中,能较精确确定液体体积的两种玻璃仪器是 、 。
(3)操作过程中多次用到玻璃棒,请分别说明它们在实验中的作用:操作②中 、操作③中 。
(4)不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响(填“偏大”、“偏小”或“无影响”)。
a.在第②步操作中,有少量液体溅出烧杯外: 。
b.在第③步操作中,容量瓶内本来有少量水: 。
c.在第⑤步操作中,若俯视刻度线: 。
d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线: 。
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请填写标签上的内容(如图) 。
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。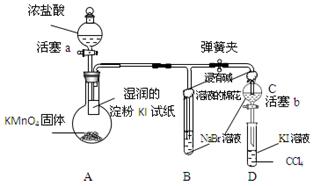
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,然后关闭活塞b,……
(1)已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应常用于实验室常温下制氯气。请用双线桥法标出此反应中电子转移的方向与数目,若该反应中生成标准状况下的氯气体积共0.112 L,则转移的电子数目为 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的化学方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ还需补充的操作为 。可观察到的现象是 。
(5)D中溶液发生反应的化学方程式是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号