有机物A可由葡萄糖发酵得到,也可 从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g。 |
(2)A的分子式 为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有种氢原子。 |
| (5)综上所述,A的结构简式。 |
(14分)已知A、B、C、D、E是原子序数依次增大的前20号元素,B、C、D同周期,A、D同主族,B的焰色反应呈黄色,C是地壳中含量最丰富的金属元素,E元素的原子核外无未成对电子(稀有气体除外),且E的原子序数比D大4
(2) B,C的笫一电离能较大的是_____(填元素符号)。
(3) A的氢化物的分子空间构型为_____,其中心原子采取_____杂化。
(3 ) A和D的氢化物中,沸点较高的是_____ (填化学式),其原因是=____________________
(4 )仅由A与B元索組成,fl原子个数比为1: 1的化合物中化学键的类型有__________
(5)E单质在A单质中燃烧是得到一种白色品体,该晶体的化学式类沏为EA2,写出该物质的电子式:__________
(16分)从樟科植物枝叶提取的精油中含有甲、乙两种成分: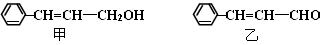
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2) 由甲转化为乙的过程为(已略去无关产物):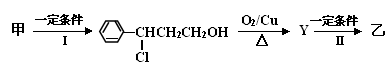
反应I的反应类型为,Y的结构简式。
(3) 1mol乙最多可与 mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式。
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的Na OH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
OH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)原NaO H溶液的质量分数为________。
H溶液的质量分数为________。
(2)所得溶液中Cl-的物质的量为________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
新切开的金属钠,切面呈________色,在空气中很快变暗,有关的化学方程式是________.将小块金属钠投入盛有水的烧杯里,钠熔化成闪亮的小球,说明________.向烧杯中滴加酚酞试液,溶液呈______色,说明 ________,反应的化学方程式为________
________,反应的化学方程式为________
根据下面的反应路线及所给信息填空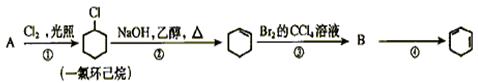
(1)A的结构简式是
(2)①的反应类型是。③的反应类型是。
(3)反应④的化学方程式是。
A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A 、C、E、F。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式 ,甲为
,甲为 (填“极性”或“非极性”)分子。
(填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,写出乙的电子式 ;常温下甲为液态,乙为气态,试解释原因。
;常温下甲为液态,乙为气态,试解释原因。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是。
⑹写出元素F的外围电子排布式。
下图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是有 特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。
特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。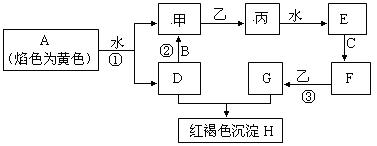
请根据以上信息回答下列问题:
(1)写出:H的化学式_________,乙的两种重要用途________________________________
(2)写出有关反应的离子方程式:
反应①__________________________________________________________
反应②__________________________________________________________
(3)判断反应③己经发生的常用试剂是______________________
(4)胶态磁流体(液溶胶)在医学上有重要用途,C单质对应元素的某种纳米级氧化物是磁流体中的重要粒子,该磁流体的主要制备过程如下:(Ⅰ)将NH3通入F、G的混合溶液(F、G物质的量比为1:2)中会生成两种碱。(Ⅱ)这两种碱恰好反应就得到该氧化物。写出(Ⅱ)中反应的化学方程式为:_________________________,确定该磁流体己成功 制取的方法_________________________________
制取的方法_________________________________
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该 规律,请判断下列反应不能成立的是______(填编号)。
规律,请判断下列反应不能成立的是______(填编号)。
A、CO2+H2O +2NaClO===Na2CO3+2HClO
B、 CO2+H2O +NaClO===NaHCO3+HClO
CO2+H2O +NaClO===NaHCO3+HClO
C、CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D、CO2 +H2O +2C6H5ONa Na2CO
Na2CO 3+2C6H5OH
3+2C6H5OH
E、Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F、CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号); pH最大的是_________(填编号)。
pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2 SO4 ⑥HClO4
SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
②侯氏制碱法中,向饱和食盐水先通入足量氨气,再通入二氧化碳,可获得小苏打晶体
根据上述反应,总结出复分解反应发生的另一规律:______________;
将KI溶液和AgCl固体混合搅拌,会观察到 的现象是_______________,请写出反应的离子方程式: __________。
的现象是_______________,请写出反应的离子方程式: __________。
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、洗气、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
①实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
②除去H2中的CO2,可用的方 法。
法。
③除去乙醇中溶解的微量食盐可采用的方法。
④粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁 及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再;然后将溶液调成中性并就可以得到较为纯净的氯化钠。
及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再;然后将溶液调成中性并就可以得到较为纯净的氯化钠。
⑤除去氧化钙中的碳酸钙可用的方法。
| A.食盐 | B.食醋 | C.苹果汁 | D.葡萄糖 E.青霉素 F.环丙沙星 |
请按要求对号入座(填序号)。
富含维生素C的是;可直接进入血液,补充能量的是;应用最广泛的抗生素之一的是;既可作为调味剂,又可消毒的是;食用过多会引起血压升高、肾脏受损的。
(1)家庭用漂白粉(主要成分氯化钙和次氯酸钙)平时要密封避光存放以免变质,请用化学方程式解释
, ;
(2)某人在刷厕所时,把漂白粉和洁厕灵(主要成分HCl)混合使用,结果造成氯气中毒, 反应的化学方程式, 若此反应转移电子数为4mol,则反应中被氧化的HCl的物质的量为。
(6分)有机物A是合成药物(芬必得)的主要原料,其结构简式为 ,与A具有相同分子式,且苯环上只有一个取代基的有机物共有4种,除A以外还有的3种分别为:
,与A具有相同分子式,且苯环上只有一个取代基的有机物共有4种,除A以外还有的3种分别为:
向一个体积可变的密闭容器中充入4 mol A、1 mol B,发生如下的反应:4A (g)+B(s) 3C(s) +4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1 。请填写下列空白:
3C(s) +4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1 。请填写下列空白:
(1)若容器体积为10 L,反应经2 min达平衡,则以A物质浓度变化表示的化学反应速率为,达平衡时A物质的转化率为。
(2)若压缩容器增大压强,则逆反应的速率,容器中D的体积分数。(填“增大”“减小”或“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减小,则正反应。(填“吸热”或“放热”)
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6 mol·L-1,则容器的体积是L。