有机物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下: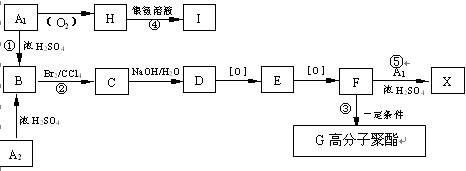
(1)反应①属于反应,反应②属于反应
(2)写出A2物质的结构简式:A2
(3)书写化学方程式:
③④⑤
(4)化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,分别写出它们的结构简式: ;;;。
;;;。
(9分)短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1∶1的离子化合物A,X与Z能形成原子个数比为1 ∶1的共价化合物B,它们之间能实现如下图所示的转化(部分产物已略去):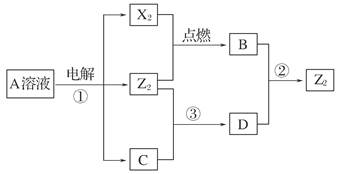
(1)Y在周期表的位置是______;Z2的电子式是______。
(2)反应①的化学方程式是_________________________________________________。
(3)D溶液呈碱性的原因是(用离子方程式表示)__________________________;D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如下图所示(夹持固定装置的仪器已略去)。
Ⅰ.写出反应②的离子方程式______________________________________________。
Ⅱ.上述实验装置不够完善,改进方法是_____________________________________。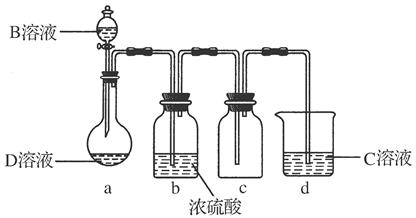
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是3Z2+6C5A+YZO3+3H2O,3 mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是________。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,C为 (写元素符号)。
(2)写出A、B的化合物与E反应的化学方程式:
。
(3)A、B两元素形成化合物属(“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:
。
(9分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。
请回答下列问题。
(1)对NO的叙述正确的是________(填序号)。
A.NO是一种无色有毒的气体 B.常温、常压下,NO难与空气中的O2化合
C.含等质量氧元素的NO和CO的物质的量相等 D.NO易溶于水,不能用排水法收集
(2)NO对环境的危害在于________(填序号)。
A.破坏臭氧层 B.高温下能使一些金属被氧化 C.造成酸雨 D.与人体血红蛋白结合
(3)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式为:_________________________________________。
(4)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:___________________________________________。
(5)解释变化(4)中为什么最后的气体总压力小于原压力的2/3?
________________________________________________________________________
________________________________________________________________________。
某有机物A在酸性溶液中加热可发生如下反应: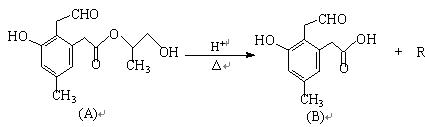
请回答下列问题:
(1)下列关于该有机物A说法错误的是。
①可发生银镜反应②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为;B在铂的催化下,与足量氢气发生加
成反应生成X,则X的结构简式为。
(3)有机物R的结构简式为; R与足量的醋酸发生反应(填基本反应类型)的化学方程式为:
。
硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式:。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) 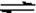 [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10—7 K2=4.7×10—11 |
K=1.75×10—5 |
下列说法正确的是。
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
根据下面的反应路线及所给信息填空。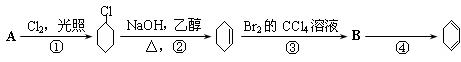
(1)A的结构简式是,名称是。
(2)①的反应类型是,③的反应类型是。
(3)反应④的化学方程式是
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a。
①试说明HnB的酸性强弱_______________________________________。
②当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)________________.
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为_____。c(OH-)-c(HB)=__。
④当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为_____(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=_________,该温度下XnYm的溶解度S=____________。
含有少量二价锰盐的溶液,在浓HNO3中与PbO2混合煮沸,溶液呈现紫红色,PbO2转化为Pb(NO3)2,反应中无气体生成,该反应的离子方程式为_____________________,每消耗1mol氧化剂,被氧化的还原剂的物质的量为_______mol。
科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
(1)元素的原子间反应最容易形成离子键的是下列中的(),元素的原子间反应容易形成共价键的是下列中的()
A.c和f B.b和g C.d和g D.d和e
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是()。
A.ea3 B.ag C.fg3 D.dg4
(3)由11种元素的几种非金属元素构成的离子化合物的电子式为______。
(4)c与e可形成一种化合物,试根据原子结构写出该化合物的化学式 ,
化学键类型为 ,与稀盐酸反应的方程式为.
(12分) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。 

血红素的结构式
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是,写出基态Fe原子的核外电子排布式 。
。
⑵血红素中N原子的杂化方式为,在右图的方框内用“→”标出 Fe2+的配位键。
Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为。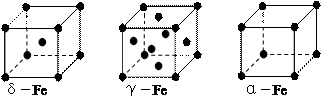
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有以下5种物质:SO2、SiO2、CaO、Fe2O3、Na2O2、Al2O3。按照不同的分类标准,它们中有一种物质与其它物质有明显的不同,请找出这种物质并写出依据(试写出任意一种合理的分类方法):。
(2)从上述物质中分别找出两种能相互反应的物质,试写出符合下列条件的方程式各一个:
①属于氧化还原反应,
②属于非氧化还原反应。
铁及其化合物之间的相互转化可用下式表示: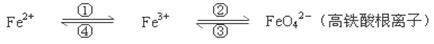
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
a.Cl2 b.Fe c.HNO3 d.H2O2
d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5 Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 +K2O2→K2FeO4 +K2O +K2SO4 +O2↑