(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3— + 4H+ + 3e- NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 等化学性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是 。
(6分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g) CH3OH(g)ΔH="-129.0" kJ·mol-1
CH3OH(g)ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 _____________。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式 _______ 。
②写出Co3+除去甲醇的离子方程式 。
氯气在298K、100kPa时,在1L水中可溶解0.090mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________;
(2)根据离子方程式,计算该反应的平衡常数(水视为纯液体,列式计算,保留2位有效数字)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;(填“正”、“逆”或“不”)
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。(填“正”、“逆”或“不”)
(5)新制氯水经光照一段时间后溶液c(H+)增大,请运用平衡移动原理进行解释:__________________。
(9分) 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为 :
(2)A与溴的四氯化碳溶液反应的化学方程式为 ,反应类型是 ;
(3)已知: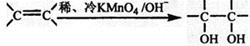 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式 ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式 ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。
(8分)工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_____________________________(任写一条)。
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式:___________________________________________________。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
2.0 |
1.0 |
0.8 |
0.7 |
0.7 |
0.7 |

(1)已知升高温度,NO2的浓度减小,则该反应是 热反应。
(2)下图中表示NO2的变化的曲线是 用O2表示从0~2 s内该反应的平均速率v = 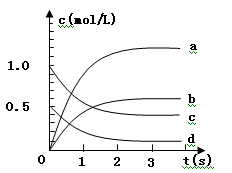
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。
(1)下列各组物质中有一种物质从化学性质角度看与其它物质不属于同一类,请将其挑出来(余下的必须属于同类),并说明理由。
| 物质组 |
不属于同类的物质 |
理由 |
| (1)MgO、SO3、CaO、Al2O3 |
|
|
| (2)H2O、HBr、CH4、NH3 |
|
|
| (3)HCl、H2SO4、HNO3、H3PO4 |
|
|
(2)请对以下过程形成的分散系进行分类
①花生油加入到水中后充分搅拌;
②向蒸馏水中加入硝酸钾至恰好饱和;
③饱和氯化铁溶液中逐滴加入少量氢氧化钠溶液;
④氢氧化钡溶液中通入过量的CO2;
⑤用滤纸过滤氢氧化铁胶体后得到的滤液;
⑥将纳米材料分散在塑料中制备复合材料;
⑦碘水和酒精的混合物。
属于浊液的是:____(填序号,下同);属于溶液的是:_____;属于胶体的是:_____。
(10分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g) 2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
2C(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD。由此推断:
(1)生成D的反应速率 。
(2)B的平衡浓度为 。
(3)A的转化率为 。
(4)该温度下的平衡常数K= 。
(5)如果增大反应体系的压强,则平衡体系中C的转化率 。(填“增大”或“减小”或“不变”)
某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。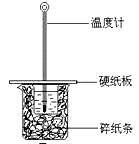
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)氢氧化钠溶液稍过量的原因是 。
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会: 。(填“偏大”、“偏小”或“无影响”)
(4)实际实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸时俯视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
中学化学常见物质A在一定条件下发生如下反应:A+B→E+F+H2O(未配平)
(1)若A为小苏打,F为气体。该反应的离子方程式为 。
(2)若A为紫红色金属单质,气体F是由两种位于同一主族的短周期元素组成。则E的化学式为________。
(3)若A是磁铁矿的主要成分,B是盐酸。写出反应的化学方程式为 。
(4)若A为黄绿色气体单质,F的碱性溶液吸收废气中SO2的离子方程式为 。
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题: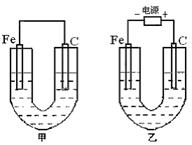
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)。
(2)①若两池中均盛有CuSO4溶液,反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②乙池中碳极上电极反应式是 。
(3)若两池中均盛有饱和NaCl溶液,
①写出乙池中总反应的化学方程式为 ,
②若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变 ,发生此现象的离子方程式为 ;若往乙池中滴入酚酞试液, (填铁或碳)棒附近呈现红色。
③若乙池中通过0.02mol 电子后停止实验,反应后池中溶液体积是200mL,溶液混匀后的c(OH-)为 。
实验室用Na2CO3·10H2O晶体配制0.02 mol/L的Na2CO3溶液480 mL。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ;
② 实验中两次用到玻璃棒,其作用分别是 、 。
(2) 应用托盘天平称取Na2CO3·10H2O晶体的质量为: g。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠晶体失去了部分结晶水; ②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠; ④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有 ;
b.偏低的有 ;
c.无影响的有 。
Na、Cu、O、Si、S、Cl是常见的六种元素。
(l)Na位于元素周期表第___周期第____族;S的基态原子核外有____个未成对电子;Si的基态原子核外电子排布式为___________
(2)用“>”或“<”填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
| Si_____S |
O2-_____Na+ |
NaCl_____Si |
H2SO4____HCl O4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是___________________。
(4)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目_________________。
(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6 kJ的热量,试写出对应的热化学方程式 。
标准状况下11.2L氢气在氯气中充分燃烧放出的热量是 kJ。
(2)A(g)+B(g) C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
①反应物A(g)和B(g)具有的总能量 (填大于、小于、等于)生成物C(g)和D(g)具有的总能量。
②该反应是_ _反应(填吸热、放热),△H= (用E1和E2表示)
(每空4分,共12分)
(1)已知:TiO2(s)+2Cl2 (g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g) Δ H=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(2)在25℃,101KPa时,CO的燃烧热为280kJ/mol,写出 CO的燃烧热的热化学方程式: 。
(3)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,
请写出该反应的热化学方程式