A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A 、C 、E 、F 。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式  ,甲为
,甲为  (填“极性”或“非极性”)分子。
(填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,写出乙的电子式  ;常温下甲为液态,乙为气态,试解释原因 。
;常温下甲为液态,乙为气态,试解释原因 。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 。
⑹写出元素F的外围电子排布式 。
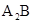 型氢化物均为
型氢化物均为 型分子,c的
型分子,c的 价离子比e的
价离子比e的 价离子少8个电子。回答下列问题;
价离子少8个电子。回答下列问题; 型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是(每空填一种)。
型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是(每空填一种)。 ;②
;②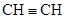 ;③
;③ ;④
;④ ;⑤
;⑤ 填写下列空白(填序号)
填写下列空白(填序号) 杂化的化合物是,采取
杂化的化合物是,采取 杂化的化合物是,采取
杂化的化合物是,采取 杂化的化合物是。
杂化的化合物是。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号