(每空1分,共8分)下列微粒:① ;②
;②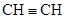 ;③
;③ ;④
;④ ;⑤
;⑤ 填写下列空白(填序号)
填写下列空白(填序号)
(1)呈正四面体的是 。
(2)中心原子轨道采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 。
杂化的化合物是 。
(3)所有原子共平面的是 ,共线的是 。
(4)微粒存在的配位键的是 。
(5)含有极性键的极性分子是 。
(每空1分,共8分)下列微粒:① ;②
;②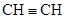 ;③
;③ ;④
;④ ;⑤
;⑤ 填写下列空白(填序号)
填写下列空白(填序号)
(1)呈正四面体的是 。
(2)中心原子轨道采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 ,采取
杂化的化合物是 ,采取 杂化的化合物是 。
杂化的化合物是 。
(3)所有原子共平面的是 ,共线的是 。
(4)微粒存在的配位键的是 。
(5)含有极性键的极性分子是 。