含氮废水进入水体后而对环境造成的污染越来越严重,对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。
⑴环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH—。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式____________________ 。
⑵水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
| 色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 加入溶液B的体积/mL |
0.0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
| 反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点是 。
②步骤二中设计色阶序号1的作用是 。
③如果水样显色后比6号还深,应采取的措施是  。
。
⑶现有含NH3为3.4mg·L—1的废水150m3(密度为1g·cm- 3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
3),可采用如下方法进行处理:将甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2 + NH3=== NO3- + H+ + H2O 6NO3-+ 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若用此方法处理,假设每步的转化率为100%,需要甲醇 g。
(10分)已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl一)>c( )>c(H+)>c(OH-)②c(Cl一)>c(
)>c(H+)>c(OH-)②c(Cl一)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_________________,上述四种离子浓度的大小顺序为______________________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为____________________________________;
若上述关系中④是正确的,则溶液中的溶质为_______________________________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好混合后溶液呈中性,则混合前c(HCl)_______________c(NH3·H2O)(填“大于”“小于”或“等于” )。
)。
(10分)甲 醛是一种重要的化工产品,可利用甲醇催化脱氢制备。气态甲醛与气态甲醇转化的能量关系如图所示。
醛是一种重要的化工产品,可利用甲醇催化脱氢制备。气态甲醛与气态甲醇转化的能量关系如图所示。
(1) 甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
(2) 过程Ⅰ与过程Ⅱ的反应热是否相同?_________,原因是_______________________。
(3) 写出甲醇催化脱氢转化为甲醛的热化学反应方程式___________________________。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_ _________ ______________________________________。
_________ ______________________________________。
( 2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式: 。
若要确认其中有Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
.现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内 层电子数的2倍。C元素最高价氧化物对应水化物X与其氢化物Y反应生
层电子数的2倍。C元素最高价氧化物对应水化物X与其氢化物Y反应生 成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答:
成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答:
(1)写出D、E两元素形成的原子个数比为1:2的化合物的电子式______________。
(2)写出Y与氯化铁溶液反应的离子方程式___________________。
(3)某盐由A、B、D、E四种元素组成,其化学式量为82。该盐水溶液呈_______性,其原因是(用离子方程式表示)_____________________。
(4)汽车尾气中含有B、C的氧化物,它们均为有害气体。可在催化剂催化下,利用这两种气体相互反应转化为无害气体。请写出该转化反应的化学方程式________________。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1) B的氯化物的熔点比其同周期相邻元素氯化物的熔点________(填高或低)。
(2)A、B、C、D的第一电离能由小到大的顺序为 __ _______________。(用元素符号表示)
_______________。(用元素符号表示)
(3)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为____________;(每个球均表示1个原子)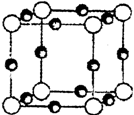
(4)F的价电子轨道表示式是______________,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______________________。
(12分)原子序数由 小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最
小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最 小的元素,Y、Z左右相邻,Z、W位于同主族。
小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在  键(填
键(填 “离子”“共价”)。
“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
B.B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学 式为 。
式为 。
②已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
(10分) 为了防止铁被腐蚀,常在铁皮表面镀上一层较耐腐蚀的金属,如镀锌铁和镀锡铁,若罐头欲装蕃茄酱,该罐头的材料应选用上述的 铁。各取一小块镀锌铁皮和镀锡铁皮,用小刀在上面刻划,露出里面的铁,然后 在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片? ;
在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片? ;
在铁片上发生的电极反应式为 ;
在另一种金属上发生的电极反应式为 。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的2倍。这四种元素的单质中常温下有 两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
⑴写出元素符号:A B C D  。
。
⑵写出两种均含A、B、C、D四种元素的化合物相互反应放出气体的化学方程式:
。
⑶用电子式表示化合物C2D形成过程  。
。
⑷用A和B两元素的单质可以制成燃料电池,电池中装有浓KOH溶液。用多孔 的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: 。
的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: 。
(10分)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸____(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式______________________________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈_______(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)__________________________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时 ,溶液中离子的浓度大小为 (填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为
,溶液中离子的浓度大小为 (填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.结晶法 | C.分液法 | D.蒸馏法 E.过滤法 |
⑴ 分离饱和食盐水与沙子的混合物。
⑵ 分离水和汽油的混合物。
⑶ 分离四氯化碳(沸点为76.75℃)和甲苯的混合物(沸点为110.6℃)的混合物。
⑷ 从碘的水溶液里提取碘。
淡黄色固体X和气体A存在如下转化关系:
请回答下列问题:
(1)固体X的名称 ;A的化学式 。
(2)写出反应①③的化学方程式,并指出氧化剂。
反应① ,氧化剂是 。
反应③ ,氧化剂是  。
。
(3)写出②④反应的离子方程式:
反应② 。
反应④ 。
(10分)乙醇分子中各化学键如图所示,则乙醇在下列反应中应断裂的键分别是
⑴.和金属钠作用时,应断裂 键
⑵.和浓硫酸共热至170 ℃时,应断裂 键
⑶.和乙酸、浓硫酸共热时,应断裂  键
键
⑷.在铜催化下和氧气反应时,应断裂 键
⑸. 和浓硫酸共热至140 ℃时,应断裂 键
(11分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题: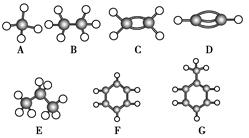
(1)常温下含氢量最高的气态烃是________(填字母)。
(2)能够发生加成的烃有________种。
(3)一卤代物种类最多的是________(填写字母)。
(4)写出实验室制D的化学方程式:__________________________________________。
(5)写出G发生硝化反应的化学方程式: 。