(10分)乙醇分子中各化学键如图所示,则乙醇在下列反应中应断裂的键分别是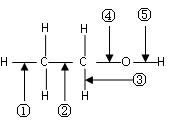
⑴.和金属钠作用时,应断裂 键
⑵.和浓硫酸共热至170 ℃时,应断裂 键
⑶.和乙酸、浓硫酸共热时,应断裂  键
键
⑷.在铜催化下和氧气反应时,应断裂 键
⑸. 和浓硫酸共热至140 ℃时,应断裂 键
(10分)乙醇分子中各化学键如图所示,则乙醇在下列反应中应断裂的键分别是
⑴.和金属钠作用时,应断裂 键
⑵.和浓硫酸共热至170 ℃时,应断裂 键
⑶.和乙酸、浓硫酸共热时,应断裂  键
键
⑷.在铜催化下和氧气反应时,应断裂 键
⑸. 和浓硫酸共热至140 ℃时,应断裂 键