二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等领域也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳。
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用双线桥法表示该反应的电子转移总数

Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积 (V)的关系如图所示
(V)的关系如图所示
写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系;
并写出与上图中不同曲线处对应的离子反应方程 式 ;
式 ;
。
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填仪器名称),操作II必须用到的仪器是______ ______(填编号)。
______(填编号)。
| A.50mL烧杯 | B.50mL量筒 |
| C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(2) 洗涤是洗去附着在沉淀上的____________。(写离子符号)
洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是_________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)
根据上述转化关系图回答:
(1)写出下列物质的化学式 X ;G
(2)物质H的电子式: ;物质J属于哪种晶体类型: 。
(3)写出反应①的化学方程式 ;
写出反应④的离子方程式 。
现有A、B;C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与.C的最外层电子数相等,A能分别与B、,C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填序号),B元素在元素周期表中的位置 。
(2)D与E可形成化合物D2E,该化合物的电子式为 。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为 。
(4)比较E、F气态氢化物的稳定性: > (用分子式表示)。
(5)B与F两种元素形成的一种化含物分子,各原子均达8电子结构,其中B显负价,F显正价,则该化合物与水反应的化学方程式为 。
氯碱工业中电解饱和食盐水的原理示意图如图所示:
(1)溶液A的溶 质是 ;
质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)



请完成下列各题:
(1)A物质的结构简式为:________________。
(2)J中所含的含氧官能团的名称为__________________________________。
(3)E与H反应的化学方程式是__________________________ ;
反应类型是________ __。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是_______________。
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式。
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。______________________________________
(18分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
已知:
(1)
(2)RCOOR1 +R2OH RCOOR2 +R1OH (R、R1、R2表示烃基)
RCOOR2 +R1OH (R、R1、R2表示烃基)
这种材料可采用以下合成路线:
试回答下列问题:
(1)反应②⑥加入的试剂X是______________________
(2)⑤的反应类型是______________________
(3)写出结构简式:B:________H:__________I:____________
(4)合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= _____∶______∶______(用m、n表示)
(5)写出化学方程式:
反应③:________________________________________________________
反应⑥:_______________________________________________________
(11分)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
(2)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(3)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物HnWC l3,反应的化学方程式为
l3,反应的化学方程式为
已知有以下物质相互转化
试回答:(1)写出B的化学式 ;D的化学式
(2)写出由E转变成F的化学方程式
(3)写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。
水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下面的能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持 不变
不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是 。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2 和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= ,以NH3表示该过程的反应速率v(NH
和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= ,以NH3表示该过程的反应速率v(NH 3)= 。
3)= 。
为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1) 过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表 示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠有发生了还原反应的是
示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠有发生了还原反应的是
A.MnO 2 2 |
B.KMnO4溶液 | C.Na2SO3溶液 | D.稀硫酸 |
(2) 漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。当生成1molClO2时转移的电子数是 。
(3) 二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2反应制得。请写出反应的离子方程式: 。
(4)工业上通常用氯气和氢氧化钠溶液反应制取漂粉精(成份次氯酸钠)写出该反应的离子方程式 。
(5)写出碳单质和浓硝酸在加热条件下反应的化学方程式:
。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: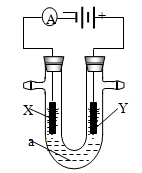
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
③若阴极生成气体22.4L(标况下) 电路中转移电子 mol
(2)如要用电解方法精炼粗铜,
①电解液a选用 溶液,则
②X电极反应式为 ,
③Y电极的材料是 。
(8分)某工厂的工业废水中含有大量的FeS O4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝
O4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝 ,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
(1)A是 , E是 ;
(2)操作Ⅱ是 ,操作Ⅲ是 。
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
⑵下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素, A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,是二元弱酸,其主要的电离方程式可表示为__________
D的化学式是_____ ____。②A、B、E中均含有的一种元素为____________ (填元素名称) 。
③E电子式为____________________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式
。
⑶在实验室我国科研人员应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N。