已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题。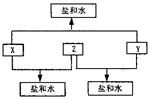
(1)D元素原子的结构示意图为( ) ;
(2)A、B、C三种元素的原子半径由小到大的顺序为( )(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为 ( ) ;
( ) ;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈( )(填“酸”、“碱”或“中”)性;
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因 是 ( )
是 ( )
(用化学方程式表示)。
已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作 是 ,需用到的玻璃仪器除烧杯外有
是 ,需用到的玻璃仪器除烧杯外有  。
。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 
 。
。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 
。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_____________________________。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式: 。
若要确认其中有Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同 学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为: 。
学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
(9分)电 解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)X的电极名称是 (填写“阳极”或“阴极”)。
(2)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 , Y电极的材料是 。
Y电极的材料是 。
(3)若X、Y都是惰性电极, a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是 ,Y极上的电极反应式为 。
a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是 ,Y极上的电极反应式为 。
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是 。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |
、氢氧燃料电池是符合 绿色化学理念的新型发电装置。
绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: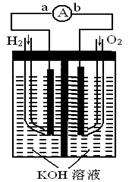
(1)氢氧燃料电池的能量转化主要形式是 ,
在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续
不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ. 2Li + H2 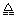 2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
⑴通常状况下,甲同学取1 mol H2O加热到100℃时,液态水会汽化为水蒸气(如图所示),该过程属于 变化。
在保持压强不变的情况下,水蒸气的体积 22.4L 。(填“>”、“<”或“=”)
⑵乙同学做H2在O2中燃烧的实验,该实验过程属于 变化,
在该变化过程中,一定保持相等的是 (填序号)。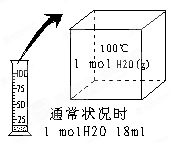
| A.反应物分子数目与生成物分子数目 |
| B.反应物原子总物质的量与生成物原子总物质的量 |
| C.反应物总质量与生成物总质量 |
| D.反应物体积与生成物体积 |
(10分).近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-) 
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单 质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+
质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+ Sx 、
Sx 、
CO+ Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为__________________________________________。
(2) B装置的名称是___________________;E装置的作用__________________________。
(3)通入C装置的两根导管左边较长、右边较短,目的是___________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________________________________。
(共12分)某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B。A、C、E、G、I含有同种元素,C为黄色固体单质。B、D、F、H、J含有同种元素,B可与 J反应生成盐。W是前四周期含有4个未成对电
J反应生成盐。W是前四周期含有4个未成对电 子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y →D+Z的化学方程式
(4)由E直接转换成I可以加入 (填写两种属于不同类别的物质)。
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole-,写出此反应的离子方程式 。
(6)将1mol/L200mL I和1mol/L100mL J溶液混合,加入到含有0.5mol的W中,则产生气体的物质的量为
25℃时,①醋酸②次氯酸③氢氟酸的电离常数分别是1.8×10-5、3.0×10-8、3.5×10-4。请推测:
(1)它们的酸性由强到弱的顺序为______________________(填序号,下同),
(2)相同浓度的溶液中,氢离子浓度最大的是___________;
(3)氢离子浓度相同的溶液中,酸的浓度最大的是 。
(10分,每空2分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= , 该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol, n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
铝是生活中很常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是
。
(2)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)  ;
;
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为 。
4分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S ="=" K2S+2NO2↑+CO2↑。在该反应中KNO3表现出 性,被还原的元素是 。