下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(3)③的气态氢化物的电子式 。
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式
、 。
(5)单质①在单质⑧中燃烧,火焰为 色。
(1、2、3班必做)根据题意回答下列问题
(1)写出基态Fe2+离子核外电子排布式 ;基态氟原子价电子排布图 。
(2)电负性:S O(填写“<”或“>”,下同));第一电离能:N F。H3O+空间构型是 ,SO32-离子中S杂化类型是 。
(3)HCN分子中σ键与π键数目之比为___________。
(4)与CN‑互为等电子体的分子是 (写分子式)。
1~20号元素(稀有气体元素除外)中:
(1)原子半径最小的是 ,原子半径最大的是 。
(2)与水反应最剧烈的金属单质是 ,非金属单质是 。
(3)既能与酸反应,又能与碱反应的金属单质是 。
(4)硬度最大的单质是 。
(5)气态氢化物的稳定性最强的是 。
(6)最高价氧化物对应的水化物碱性最强的是 (以上填元素符号或化学式)。
(7)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 周期、第 族。
下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ;
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为 ;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是 (填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是 (填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是 ;当消耗4.8g①的单质时,转移电子数为 。
现有A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子有两个未成对电子;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:
(1)A、D元素的名称分别为:A ,D .
(2)X与等物质的量的HCl反应,产物溶于水得________(填“酸性”、“中性”或“碱性” )溶液,用离子方程式表示其原因 .
(3)12g B单质在空气中完全燃烧,将燃烧后的气体缓慢通入1L1 mol·L-1的NaOH溶液中,充分吸收后,最终所得溶液中各离子浓度由大到小的顺序是: __.
(4)把1molC的单质、3molA的单质置于一恒温恒容密闭容器中反应,达到平衡时,放出a kJ 的热量, 此时,容器内的压强是反应开始时的75%,写出该反应的热化学方程式 ______________________
(14分)X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。Y原子最外层电子数与核外电子总数之比为3:4,M与Y同主族,N﹣、Z+、X+离子的半径逐渐减小,X、N可形成化合物A,常温下A为气体。据此回答:
(1)M在周期表中的位置是__________,Z单质与A的水溶液反应的离子方程式表示为___________。
(2)X、Z、M三种元素可形成酸式盐B,则B的电子式为_______,B中含有的化学键类型是________。
(3)X与Y、M可分别形成含有18个电子的分子C和D,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式_______________
(4)已知通常状况下1 g X2在Y2中完全燃烧放出a kJ的热量。请写出表示X2燃烧热的热化学方程式____
(5)由X、Y、Z、M四种元素组成化合物E在熔融状态下能电离出两种离子,写出E在水溶液中的电离方程式_______________。
①16O和18O
②红磷和白磷
③CH3CH3和CH3CH2CH2CH3
④CH3CH2CH2CH3和CH3CH (CH3)CH3
⑤O2和O3
⑥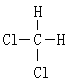 和
和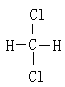
(1)属于同素异形体的是 。
(2)互为同位素的是 。
(3)互为同分异构体的是 。
(4)属于同系物的是 。
(5)属于同种物质的是 。
写出符合下列要求的符号。
(1)第二电子层 s能级________
(2)n=3 p能级________
(3)第五电子层 d能级________
(4)n=4 p能级________
(5)n=2 p能级沿y轴取向的轨道________
当n=4时(n为主量子数,n值所表示的电子运动状态称为电子层),电子层的最大容量为________个电子,如果没有能级交错,该层各轨道的能量由高到低的顺序为________。
下图是各个原子的性质和原子序数(1~20)的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、中子数、最高正价、原子半径相对大小、得电子相对能力。图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值。
(1)图1~图4的纵轴分别代表________、________、______。
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:a+b=c,(e+c)/2=c,(c+e)/2=d,请根据提供的信息,回答下列问题:
①下图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置。
②写出铜与上述某一元素最高价氧化物对应水化物反应的化学方程式: _________(任写一个即可)。
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,其相应的化学方程式为__________;若X、Y、Z、W均为化合物,其相应的化学方程式为______________________________(任写一个,合理即可)。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为__ _ _ _ _ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)要证明太阳上是否含有R 元素,可采用的方法是 。
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________(填元素符号)
②MO=Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________(填分子式)。
(10分)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A:__________;B:__________;C:__________;D:_______。
(2)写出A、B、E三种微粒反应的离子方程式:__________________。
有下列各组物质:
| A.O2和O3; |
| B.126C和136C; |
| C.CH3-CH2-CH2-CH3和CH3-CH(CH3)CH3; |
| D.冰醋酸和乙酸; |
E.甲烷和庚烷;
F.淀粉和纤维素。
(1) 组两物质互为同位素。
(2) 组两物质互为同素异形体。
(3) 组两物质属于同系物。
(4) 组两物质互为同分异构体。
(5) 组是同一物质。
下表是元素周期表的一部分,针对表中的①~⑨种元素,用化学用语填空:
(1)元素②的原子结构示意图为___________,元素②原子核内含有6个中子的原子可表示为________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是__________。
(3)元素①与⑥形成的化合物的电子式为:_______________。
(4)⑤、⑥、⑨三种元素形成的简单离子,离子半径由大到小的顺序是_______________。
(5)实验室用元素③的氢化物制取③的单质的反应为______________________________。