江西省新余市高一下学期期末考试化学试卷
2015年6月5日是世界环境日,今年的主题是“践行绿色生活,”下列有关说法中错误的是
| A.煤的气化、液化是使煤变成清洁能源,减少环境污染的有效途径 |
| B.高纯硅可制作太阳能电池,二氧化硅可制作光导纤维 |
| C.利用工业生产产生的二氧化碳制造全降解塑料,可以缓解温室效应 |
| D.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
有关化学用语正确的
| A.乙烯的结构简式:CH2CH2 |
B.NH4Cl的电子式: |
C.NH3的结构式为: |
D.-CH3(甲基)的电子式为: |
下列关于 原子的叙述不正确的是
原子的叙述不正确的是
| A.中子数为33 | B.电子数为33 |
| C.质量数为60 | D.质子数为27 |
镭(Ra)位于周期表的第七周期第IIA族,下列关于镭的性质的描述不正确的是
| A.在化合物中呈+2价 | B.单质能与水反应产生氢气 |
| C.氢氧化物为弱碱 | D.碳酸盐难溶于水 |
下列递变规律正确的是
| A.HClO4、H2SO4、H3PO4的酸性依次增强 |
| B.HCl、HBr 、HI的稳定性依次增强 |
| C.钠、镁、铝的还原性依次减弱 |
| D.N、O、F原子半径逐渐增大 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s) |
| B.反应开始到10 s时,Y的转化率为79.0% |
| C.t1时,Z和X的浓度相等,达到了化学平衡状态 |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法错误的是
| A.溶液中H+向负极移动 | B.电子由Zn经外电路流向Cu |
| C.Zn电极反应:Zn-2e-=Zn2+ | D.Cu是正极 |
能说明苯分中碳碳键不是单双键交替的事实是
| A.苯的一元取代物没有同分异构体 | B.苯的邻位二元取代物只有一种 |
| C.苯的间位二元取代物只有一种 | D.苯的对位二元取代物只有一种 |
下列说法中正确的是
| A.含有共价键的化合物一定是共价化合物 |
| B.组成单质的分子内一定含有共价键 |
| C.由非金属元素组成的化合物不一定是共价化合物 |
| D.不同元素组成的多原子分子里的化学键一定为极性键 |
下列反应既属于氧化还原反应,又是吸热反应的是
| A.锌粒与稀硫酸的反应 | B.灼热的木炭与CO2反应 |
| C.甲烷在氧气中的燃烧反应 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
NA代表阿伏加德罗常数,下列说法不正确的是
| A.10 g D2O中含有的电子数为5 NA |
| B.1 mol C3H8分子中共价键总数为10 NA |
| C.92 g NO2和N2O4混合气体中含有原子数为3 NA |
| D.65 g Zn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
某单烯烃与H2加成后的产物是: ,则该烯烃的结构式可能有
,则该烯烃的结构式可能有
| A.3种 | B.4种 | C.5种 | D.2种 |
为提纯下列物质(括号内为杂质),所选试剂及方法均正确的是
| 选项 |
物质 |
除杂试剂 |
方法 |
| A |
溴苯(溴) |
CCl4 |
分液 |
| B |
NH3(H2O) |
浓硫酸 |
洗气 |
| C |
乙烷(乙烯) |
溴水 |
洗气 |
| D |
CO2(SO2) |
Na2CO3饱和溶液 |
洗气 |
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“.”代表一种元素,其中O点代表氢元素.下列说法中错误的是
A.离O点越远的元素原子半径不一定越大
B.图中虚线(直线)相连的元素处于不是同一族
C.B元素是图中金属性最强的元素
D.A、B两种元素组成的化合物中可能含有共价键
等物质的量的下列物质完全燃烧时,消耗氧气的量最多的是
| A.C2H4 | B.C2H6 | C.C2H5OH | D.CH3COOH |
酸和醇可以发生酯化反应,生成酯类物质,下列酸和醇能生成相对分子质量为90的酯的是
| A.CH3C18OOH与C2H518OH | B.CH3C18O18OH与C2H518OH |
| C.CH3CO18OH与C2H518OH | D.CH3CO18OH与C2H5OH |
①16O和18O
②红磷和白磷
③CH3CH3和CH3CH2CH2CH3
④CH3CH2CH2CH3和CH3CH (CH3)CH3
⑤O2和O3
⑥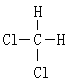 和
和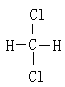
(1)属于同素异形体的是 。
(2)互为同位素的是 。
(3)互为同分异构体的是 。
(4)属于同系物的是 。
(5)属于同种物质的是 。
现有A、B、C、D四种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)B在周期表中的位置 。
(2)写出A的氢化物中原子个数为1:1的物质的电子式: 。
(3)写出CD的溶液与氯气反应的离子方程式 。
(4)比较A、B两种元素形成的简单离子半径的大小(用离子符号表示): 。
可以将氧化还原反应2H2+O2=2H2O设计成原电池。(每空2分)
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_______________;负极的电极反 应式为________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为_______________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出B电解生成E和D的反应方程式: 。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式 ,该反应消耗了2 molG,则转移的电子数是 。
石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。(每空2分)
(1)A的分子式为________________。
(2)写出:反应①的化学方程式: ;该反应的类型是_______________。反应③的化学方程式:____________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:______________。
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为____________;A与该烃的体积比为_____________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号