已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(2)Z元素位于元素周期表________区,目前该元素发现________种同位素;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是__________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物沸点由高到低顺序是(用化学式表示)______.
回答下问题:
(1)C、N、O三种元素的第一电离能由大到小的顺序是__________________。
(2)C、Si、N的电负性由大到小的顺序是__________________。
(3)氟化氢水溶液中存在的氢键有_________种。
(4)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有________种能量不同的电子。很多不饱和有机物在Ni催化下可以H2发生加成反应。如①CH2=CH2、②HC≡CH、③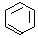 、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
合成尿素的反应为: 完成下列填空:
完成下列填空:
(1)写出NH3的电子式 ;画出碳原子结构示意图 ;氧元素位于周期表第 周期第 族。
(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为 。
(3)上述反应所涉及的4种元素中,非金属性最强的是 。
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)= mol/(L·min)。
(5)下列能说明上述反应己达平衡的是 。(填序号)
a.2c(NH3)=c(H2O) b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是 。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
X、Y、Z、Q、R、T分别代表原子序数依次增大的短周期元素。X、Y、Z同周期且相邻, 都是蛋白质的组成元素;X、T同族,Q与R原子的最外层电子数之和与T原子的最外层电子数相等。U是d区元素,U2+的核外最高能级有2对成对电子。
都是蛋白质的组成元素;X、T同族,Q与R原子的最外层电子数之和与T原子的最外层电子数相等。U是d区元素,U2+的核外最高能级有2对成对电子。
请回答下列问题:
(1)Q原子的核外电子排布式为 。
(2)XZ2的分子中σ键与π键数目之比为 ,YZ2-离子的VSEPR模型名称是 。
(3)Q、R、T的单质形成的晶体中,熔点由高到低的顺序是 (填化学式),既能与强酸反应,又能与强碱反应的是 (填化学式)。
(4)通常情况下,U2+的溶液很稳定,它与YH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为 [U(YH3)6]3+,该反应的离子方程式是 。
(1)补充完成F表:(请把序号①一⑦的答案对应填入答题卡上)

(2)甲元素最高价氧化物对应的水化物呈 性(填“酸、碱”),乙元素对应的最高价氧化物的水化物的化学式为 。
(3)甲与乙两元素的单质反应生成物的电子式为 。
(4)甲单质与丙的氢化物反应的化学方程式为 。
铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 ① 周期,第② 族:PbO2的酸性比CO2的酸性 ③ (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 ④ 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ⑤ ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式
⑥ ,阴极观察到的现象是 ⑦ ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式 ⑧ ,这样做的主要缺点是 ⑨ 。
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素, D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为 。
(2)AB2分子中,A的杂化类型为 ;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(3)B的氢化物与D的氢化物的沸点较高的是 (用化学式表示),原因是 。
(4)AB2形成的晶体的熔点 (填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是 .
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为 (用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式 。

(6)由C、D两元素形成的化合物组成的晶体中,晶胞结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为 g·cm-3。(已知阿伏伽德罗常数为NA)。


五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、
E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。
A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。
E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A元素在周期表中的位置 ;
(2)乙物质中存在的化学键类型是 ;
(3)写出C与D的最高价氧化物对应的水化物相互间反应的离子方程式 ;
(4)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的有效成分的化学式为 。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。请回答以下问题:(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 。
(2)今年8月1 2日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①已知HCN力一元弱酸,则NaCN溶液的pH 7(填“>”“=”或“<”)。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3一,同时生成NH3,该反应的离子方程式为 方法二:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如右图所示(图中“HA”表示乳酸分子,A表示乳酸根离子)。阳极的电极反应式为 简述浓缩室中得到浓乳酸的原理

碘元素的一种核素12553I可用于治疗肿瘤。该核素的质子数为_____________,中子数为__________,质量数为__________,核外电子数为___________.
已知A、B、C、D、E都是周期表中的前四周期的元素, 它们的核电荷数A<B<C<D<E。其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示。原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
试回答下列问题:

(1)基态Ga原子的核外电子排布式为: 。
(2)A、B、C的第一电离能由大到小的顺序: (用元素符号表示)。
(3)B元素的单质分子中有 个π键,与其互为等电子体的物质的化学式可能为 (任写一种)。
(4)上述A的氧化物分子中心原子采取 杂化,其晶胞中微粒间的作用力为 。
(5) EH3分子的空间构型为 ,其沸点与BH3相比 (填“高”或“低”),原因是
(6)向CuSO4溶液中逐滴加入BH3的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式 .
W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻.已知W元素的氢化物与Z元素的氢化物反应只生成一种盐a;X,Y位于同一族,它们能组成YX2,YX3两种常见化合物.请回答下列问题:
(1)X元素位于周期表的位置为_____________________________________
(2)X,Y,Z三种元素形成的单质中,氧化性最弱的是___________(填化学式).
(3)a溶液的pH__________7(填“>”、“<”或“=”),用离子方程式解释为:__________.
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为__________.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为______________________
(5)工业上用氧化WH3法制取WO,该反应的热化学方程式为:
4WH3(g)+5O2(g)=4WO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知W2(g)+O2(g)=2WO(g) △H="+180" kJ·mol-1,则WH3与氧气反应产生两种无污染物质的热化学方程式为 。
在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
| |
|
|
|||||||
| |
|
|
|
|
C |
D |
|
|
|
| A |
|
|
|
B |
|
|
E |
F |
|
(1)画出D的原子结构示意图 ;
(2)写出C的最高价氧化物的电子式 ,该化合物所含化学键为 ;
(3)E和F分别形成的气态氢化物中最稳定的是 (填写氢化物的化学式);
(4)A最高价氧化物的水化物的化学式 。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称为___________;B在周期表中的位置是第___________周期第___________族。
(2)C的元素符号为______________,C的最高价氧化物的化学式为__________________。
(3)D的最高价氧化物对应的水化物的化学式为______________。
有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g水。质谱图表明其相对分子质量为84;红外光谱分析表明A中含有—O—H和位于分子端的CCH,核磁共振氢谱显示有3种峰,且峰面积之比为6∶1∶1。
(1)写出A的分子式_________________;
(2)写出A的结构简式____________________;
(3)下列物质一定能与A发生反应的是____________________(填序号)
a.H2 b.Na c.KMnO4 d.Br2
(4)有机物B是A的同分异构体,1 mol B可以与1 mol Br2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示有3种峰,且峰面积之比为6∶1∶1,则B的结构简式是___________。