M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为____________,P的基态原子价层电子排布式为____________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为______________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为__________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________,其中M离子的配位数为__________,该晶体类型为______________。
(5)该晶胞的边长为a×10-10cm,则距离最近的M、N离子间的距离为__________ 。
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
|
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
⑤ |
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)单质为有色气体的元素是___________(填名称)。
(2)③④⑤简单离子的半径由大到小的顺序为_____________(填离子符号)。
(3)元素②的单质的电子式为________________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为_____________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是__________,写出一个能表示二者非金属性强弱关系的化学方程式为:______________。
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
| |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|
|
|
|
|
|
|
| 2 |
② |
③ |
|
④ |
⑤ |
⑥ |
⑦ |
|
| 3 |
⑧ |
|
|
|
|
⑨ |
⑩ |
|
(1)自然界物质种类最多的元素在周期表中的位置是_____________________
(2)⑧⑨⑩的离子半径由大到小的顺序为 (填化学用语)。
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式_____________________
(4)②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________________
(5)根据斜线性质相似规则,③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式___________________________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,
写出该反应式__________________________
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。

(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
A、B、C、D、E为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E处于同一周期,E原子的最外层电子数是A、B、C原子最外层电子数之和,D是地壳中含量最高的金属元素;A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝;E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),25℃时0.1 mol/L的乙溶液pH>l;D的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐丁,也能与丙的水溶液反应生成盐。
请回答下列问题:
(1)甲的化学式为 ;B单质的电子式为 。
(2)D元素的名称是 。
(3)写出丁溶液中通入过量二氧化碳时的离子方程式
(4)工业上利用A、B的单质合成甲(BA3):B2 (g)+3A2 (g)  2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
(5)E的单质与甲反应生成的乙和丙的物质的量之比为2:4.反应中被氧化的物质与被还原的物质的物质的量之比为 。
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大, W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)L的元素符号为 ;M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 。
(3)Y的最高价氧化物的电子式为 。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:① A、B 、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使石蕊试纸变色;② A和I相遇产生白色烟雾;③ B和E都能使品红溶液褪色;④ 将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;⑤ 将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;⑥ C和D相遇生成红棕色气体;⑦ G在D中燃烧可以产生E和H2O;⑧ 将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。回答:
(1)A的化学式是 ,②中烟雾的化学式是 ;
(2)④中发生反应的化学方程式是 ;
(3)⑤中发生反应的化学方程式是 ;
(4)C的化学式是 ,D的化学式是 ;
(5)⑦中发生反应的化学方程式是 ;
下表为元素周期表前三周期的一部分。
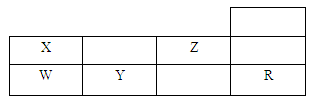
(1)X的氢化物与W的氢化物的比较稳定的是: (填化学式)。(2)从下列选项中选出X的基态原子的最外层原子轨道表示式 ,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合 。(填序号)。
A.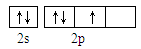 |
B.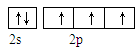 |
| C.泡利原理 | D.洪特规则 |
(3)以上五种元素中, 元素的电负性最大(填元素符号)。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
所有元素中电负性最大的元素 |
| X |
L层p电子数比s电子数多2个 |
| Y |
其最高价氧化物呈两性 |
| Z |
L层有三个未成对电子 |
(1)写出元素X电子排布式 。
(2)Z原子共有 种运动状态不同的电子。
(3)写出Z元素形成的单质的结构式: 。
(4)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述 中能证明这一事实的是
A、常温下氯气的颜色比T单质的颜色深
B、T的单质通入氯化钠水溶液不能置换出氯气
C、氯与T形成的化合物中氯元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 (填化学式),理由 。
(6)T与Z形成的化合物含有的化学键类型 。
下表为周期表的一部分,其中的编号代表对应的元素。
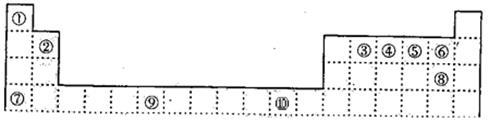
(1)⑨是 (填元素名称)。
(2)画出⑥的离子结构示意图 。
(3)元素⑦和⑧形成的化合物属于 晶体,它比NaF的熔点 (填“高”或“低”)。
(4)在 ①~⑩ 元素的最高价氧化物的水化物碱性最强的是 ,酸性最强的是 。(填化学式)
(5)⑧形成的最高价氧化物化学式是 。
(6)元素⑩在元素周期表的 族,其原子的外围电子排布式 。
(7)第四周期所有元素的基态原子中,4p轨道半充满的是 (请填元素符号,下同),4s轨道半充满的是 。
下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是 。
(4)在B、C、D、G、I中,原子半径最大的是 。
(5)元素C与I形成的化合物的电子式是 。
随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价如图所示。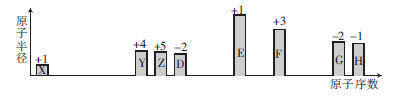
(1)元素Z位于元素周期表的第__________周期___________族,X与Z可形成18电子的化合物,该化合物的电子式为_______________。
(2)非金属性:Y___________(填“>”“<”或“=”)D。
(3)单质F与EDX溶液反应的化学化学方程式为____________________。
(4)G和H可形成一种化合物,其相对分子质量在90~110之间。且G的质量分数约为31.1%,该化合物的化学式为_________。