山西省孝义市高一下学期升级考试化学试卷
“地球一小时”熄灯活动,以倡导节能减排理念.下列不能达到节能减排目的是
| A.利用太阳能发电 | B.用家用汽车代替公交车 |
| C.利用化石燃料制造燃料电池 | D.用节能灯代替白炽灯 |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式: |
B.质量数为37的氯原子: |
C.NH4Cl的电子式: |
D.原子核内有10个中子的氧原子: |
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是
| A.v(N2)=0.1mol·L-1·s-1 |
| B.v(H2)=0.1mol·L-1·min-1 |
| C.v(NH3)=0.15mol·L-1·min-1 |
| D.v(H2)=0.3mol·L-1·min-1 |
以下反应属于取代反应的是
| A.乙烯使酸性高锰酸钾溶液褪色 |
| B.乙烯使溴的四氯化碳溶液褪色 |
| C.甲烷与氯气混合光照一段时间后黄绿色褪去 |
| D.乙烯在催化剂作用下生成聚乙烯 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1mol Na2Mn5O10转移2mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s) + 2B(g)  C(g) + D(g) 已达平衡状态的是
C(g) + D(g) 已达平衡状态的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的平均相对分子质量 |
工业上从海水中提取溴的主要反应是:C12+2Br- = 2Cl- + Br2下列说法错误的是
| A.海水中溴元素主要以形式Br-存在 | B.上述反应属于离子反应 |
| C.溴单质比氯单质活泼 | D.上述反应属于氧化还原反应 |
在周期表中金属和非金属的分界线附近能找到
| A.制农药的元素 | B.制催化剂的元素 |
| C.做半导体的元素 | D.制耐高温合金材料的元素 |
下列与有机物结构、性质相关的叙述错误的是
| A.乙醇分子中含有羟基,能发生氧化反应、取代反应、加成反应。 |
| B.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D.乙烯和苯都能发生加成反应 |
下列说法错误的是
| A.医学上用于消毒的酒精是75%酒精溶液 |
| B.单质硅是将太阳能转化为电能的常用材料 |
| C.食醋是含3%~5%乙酸的溶液 |
| D.乙醇可做为提取碘水中碘的萃取剂 |
下列各组化合物中,化学键类型完全相同的是
| A.Na2O2和Na2O | B.MgCl2和Na2S | C.CaO和CO2 | D.HCl 和NaOH |
下列实验能达到目的的是
| A.用可见光束照射以区别溶液和胶体 |
| B.用萃取分液的方法出去酒精中的水 |
| C.通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 |
| D.只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4四种无色溶液 |
仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是( )
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
污水处理的主要方法有:①中和法 ②化学沉淀法 ③氧化还原法 ④过滤法,其中属于化学变化的是
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
设阿伏加德罗常数为NA,下列说法中正确的是
| A.标准状况下,2.24L水含有0.1NA个水分子 |
| B.0.3molSO2中含有的氧原子数为0.3NA |
| C.标准状况下,22.4L氖气含有2NA个原子 |
| D.1L 0.1mol/LMgCl2溶液中含Cl-数为0.2NA |
能用H++OH-=H2O来表示的化学反应是
| A.氢氧化镁和稀盐酸反应 | B.Ba(OH)2溶液滴入稀硫酸中 |
| C.澄清石灰水和稀硝酸反应 | D.二氧化碳通入澄清石灰水中 |
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
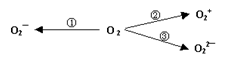
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
|
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
⑤ |
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)单质为有色气体的元素是___________(填名称)。
(2)③④⑤简单离子的半径由大到小的顺序为_____________(填离子符号)。
(3)元素②的单质的电子式为________________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为_____________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是__________,写出一个能表示二者非金属性强弱关系的化学方程式为:______________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________。
(2)在烧瓶中配制一定比例的乙醇和浓硫酸的混合液的方法是:__________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______________,原因是____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
试剂a是__________,试剂b是__________;分离方法①是__________,分离方法②是__________,分离方法③是____________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________。
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)G是一种高分子化合物,其链节是______________;
(3)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:____________________,决定F能用于冷冻麻醉应急处理的性质是___________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号