M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为____________,P的基态原子价层电子排布式为____________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为______________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为__________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________,其中M离子的配位数为__________,该晶体类型为______________。
(5)该晶胞的边长为a×10-10cm,则距离最近的M、N离子间的距离为__________ 。
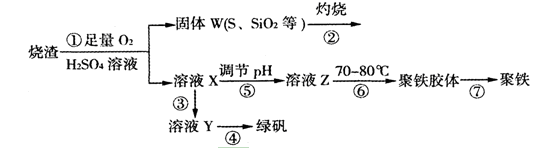
 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。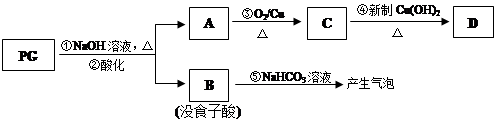
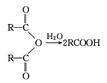
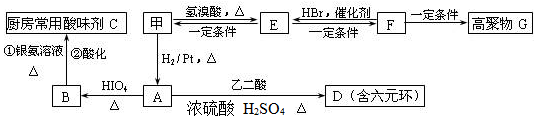
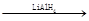 RCH2OH(其中R是烃基)
RCH2OH(其中R是烃基)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号