M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为____________,P的基态原子价层电子排布式为____________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为______________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为__________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________,其中M离子的配位数为__________,该晶体类型为______________。
(5)该晶胞的边长为a×10-10cm,则距离最近的M、N离子间的距离为__________ 。
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题: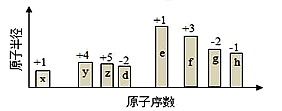
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: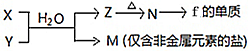
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示: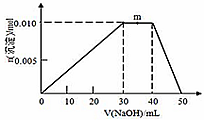
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________,从原子结构的角度解释不存在RCl5分子的原因_______。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________。
②甲→乙的化学方程式为______________。
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________。
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于 晶体。
②丙含有的作用力有 (填序号)。
A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
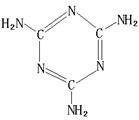
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是 。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
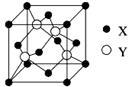
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与 E同周期;E元素原子的最外层电子数是其次外层电子数的 3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是_______________。
(2)由A、B、C三种元素形成的离子化合物的化学式为_________________。
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)_______________。
(4)F含有的化学键类型是___________和_____________,其水溶液呈酸性,请用相关的离子方程式解释其原因___________。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为______。
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| T |
原子的L层上s电子数等于p电子数. |
| X |
元素的原子半径是第三周期主族元素中最大的. |
| Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z |
单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
下图是元素周期表的一部分
(1)元素⑩的次外层电子数为__________个。
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是___________________;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式____________________;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一主族的是_________.(填元素代号)
②T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为____________。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的电负性比Y的 (填“大”或“小”);X 和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称: 。氢元素,X、Y的原子也可共同形成多种分子和几种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式: 。
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于S区的是____________________(填元素符号)。
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)____________。
(3)写出D元素基态原子的外围电子排布式__________________________________。
(4)元素电负性为B___________D,元素第一电离能为C__________E。(填“﹥”、“﹤”或“﹦”)
(5)由这五种元素组成的一种化合物是____________________(写化学式)。[来
X、Y、Z、R、T、U分别代表原子序数依次增大的短周期主族元素。X元素原子的质子数等于其电子层数;Y的基态原子核外电子有5种不同的运动状态;Z与T同主族且原子序数T是Z的两倍;R元素的原子半径在短周期主族元素中最大。请回答下列问题:
(1)Z的基态原子电子排布式为_______;TZ32-离子的空间构型为_______。
(2)T、U的最高价氧化物对应的水化物酸性由强到弱的顺序为__________(填化学式)。
(3)化合物RU的晶体类型为 ;已知RU晶胞体积为Vcm3,RU的摩尔质量为M g/mol则该晶体密度p= (用含V、M的式子表示)。
(4)将Y2X6气体通人H20中反应生成一种酸和一种单质,该反应的化学方程式是 。(已知:Y的电负性为2.0,X的电负性为2.1)
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1
c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族元素,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。
请回答下列问题:
(1)A元素单质的化学式为______ ,D元素的原子结构示意图为______ 。
(2)由A、B、C三种元素形成的化合物的电子式为______ ,这种化合物形成的晶体 中所含的化学键类型有______ 。
(3)由A、B、D三种元素形成的一种化合物和A、B两种元素形成的一种化合物能发生氧化还原反应,反应的化学方程式:________ 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______ (用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分 的挥发),溶液的pH近似为7,则该过程的总反应方程式为______ 。