A、B、C、D、E、F 6种元素,它们的核电荷数依次增大,且都小于36。其中C、E、F是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) 。
(2)元素B与D的电负性的大小关系是 ,C与E的第一电离能的大小关系是 。(填>、<、=,用元素符号表示)
(3)用轨道表示式表示D元素原子的价电子构型 。
(4)C、E最高价氧化物对应的水化物相互反应的离子方程式为 。
(5)F在元素周期表中的位置是 区,其基态原子的电子排布式为 。
(6)均为A、B、D、E四种元素组成的两种化合物可以相互反应,写出该反应的离子方程式为 。
【化学选修3—物质结构与性质】A、B、C、D、E、F、G为原子序数依次增大的前四周期元素。A、F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍; B原子核外电子分处3个不同能级。且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对.E与F同周期;G的原子序数等于A、C、D、F 四种元素原子序数之和。
(1)写出B的基态原子的核外电子排布图 ;回答E与F原子的第一电离能的大小关系怎样,原因是 ;
(2)C3-是一种弱酸根离子,请写出两种与C3-互为等电子体的分子的化学式 , ;
(3)A与D形成的A2D2分子中D原子的杂化类型为 杂化,A与C形成的最简单分子易溶于水的原因 ;
(4)G的晶体中原子按 (填“ABABAB”或“ABCABCABC”)的方式堆积而成,G的晶体堆积模型名称 ;
(5)G的晶体中G原子的配位数为 ,空间利用率为 ;
(6)元素G的一种氯化物的晶胞如图所示,该氯化物的化学式 ,两种微粒间最短距离为460.0 pm,晶体密度为 g/cm3。(列式表示)
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式为           。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式               。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是                           。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色单质,且产物对大气无污染,其化学反应方程式是                             。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为                                                       。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式              ;若0.1 mol该化合物完全反应,转移电子的物质的量为             。
A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
| B |
|
|
| |
|
F |
(1)BF2的结构式为____________。
(2)D和F的氢化物中沸点较高的是_________(填化学式)。
(3)实验室制取G2气体的离子方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为___________________________________________________。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为_______________________.
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________。
【化学—选修2:物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为________;
(2)单质A有两种同素异形体,其中沸点高的是________(填分子式),原因是________;A和B的氢化物所属的晶体类型分别为______和_______;
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为________,中心原子的杂化轨道类型_______;
(4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________,晶胞中A原子的配位数为_______;列式计算晶体F的密度_______。
【化学—选修3:物质结构】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子; B元素是地壳中含量最多的金属元素;C原子核外的M层中有两对成对电子;D是使用最广泛的合金的主要成分。E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E+离子的最外层电子排布式_____________ ,A、B、C的第一电离能最小的是____________ 。
(2)A的最高价含氧酸分子中心原子是____________________杂化。
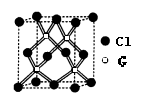
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为________ ,一个A原子周围距离最近且等距的A原子有_____________个。B原子的堆积方式与下图中的_______相同。(填“图二”或“图三”)
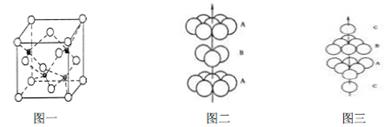
(4)1183 K 以下D 晶体的晶胞为钾型,而1183 K 以上则转变为铜型,在两种晶胞中最邻近的D 原子间距离相同,则两种晶体中原子的空间利用率之比为____(可用根号表示)。
(5)开发新型储氢材料是氢能利用的重要研究方向。分子X 可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X 一定不是______(填标号)。
A. H2O B. CH4 C. HF D. CO(NH2)2
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 元素性质或原子结构
A 周期表中原子半径最小的元素
B 原子核外有三种不同的能级且各个能级所填充的电子数相同
C 最外层p轨道半充满
D 位于短周期,其原子的核外成对电子数是未成对电子数的3倍
E 位于ds区且原子的最外层电子数与A的相同
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为______________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_______________;1 mol A2B2D4分子中含有σ键数目为____________。
(4)与化合物BD互为等电子体的阴离子化学式为________________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含______________个D原子。

针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
|
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
⑤ |
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)单质为有色气体的元素是___________(填名称)。
(2)③④⑤简单离子的半径由大到小的顺序为_____________(填离子符号)。
(3)元素②的单质的电子式为________________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为_____________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是__________,写出一个能表示二者非金属性强弱关系的化学方程式为:______________。
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
| |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|
|
|
|
|
|
|
| 2 |
② |
③ |
|
④ |
⑤ |
⑥ |
⑦ |
|
| 3 |
⑧ |
|
|
|
|
⑨ |
⑩ |
|
(1)自然界物质种类最多的元素在周期表中的位置是_____________________
(2)⑧⑨⑩的离子半径由大到小的顺序为 (填化学用语)。
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式_____________________
(4)②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________________
(5)根据斜线性质相似规则,③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式___________________________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,
写出该反应式__________________________
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图(反应条件省略)
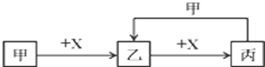
(1)若甲为气态非金属单质,丙能与人体血液中的血红蛋白结合而使人中毒,则乙的电子式为 。
(2)若甲为黄绿色气体,X为常见的金属,则X在元素周期表中的位置是 ,丙的水溶液呈 (填酸性、碱性或中性),原因是: (用离子方程式表示)。含amol乙的溶液溶解了一定量X后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的乙的物质的量是 mol。
(3)若X为酸性氧化物且具有漂白性,甲溶液的焰色反应呈黄色,则标准状况下8.96 L 气体X与2 L 0.25 mol/L的甲溶液反应生成的溶液中乙和丙的物质的量浓度之比为(不考虑离子的水解) 。另有和丙具有相同元素组成的物质丁,丙和丁能反应生成气体,写出该反应的离子方程式 。
(4)若X为强碱溶液,乙为白色胶状沉淀,则甲与丙反应的离子方程式为 。
【化学——选修3:物质结构与性质】
有A、B、C、D四种元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn-1npn-1。 D原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)ACl3分子中A的杂化类型为 。ACl3分子的空间构型为 。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。

(3)A、B、C三元素原子第一电离能由大到小的顺序为 (用元素符号表示)。C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则C60分子中π键的数目为 。
(4)D的基态原子有 种能量不同的电子;D2+ 的价电子排布式为 ;下图 (填甲、乙或丙)表示的是D晶体中微粒的堆积方式。若该晶体中一个晶胞的边长为a cm,则D晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数的值)。若D的原子半径为r ,则D晶胞这种堆积模型的空间利用率为 。(用含r的式子表示,不需化简)

甲 乙 丙
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H="-905.8" kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
(6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。

(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。