短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(一)(1)D在周期表中的位置是 ,写出实验室制备单质F的离子方程式 。
(2)化学组成为BDF2的电子式为: ,A、C、F三种元素形成的化合物CA4F为 化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是 (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为 ;每消耗3.4g CA3转移的电子数目为 。
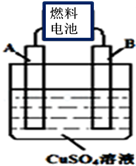
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是 ,溶液中的H+向 极移动(填“正”或“负”),t1时,原电池中电子流动方向发生改变,其原因是 。
下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
C |
N |
O |
|
|
| 3 |
Na |
Mg |
|
Si |
|
S |
Cl |
Ar |
| 4 |
|
Ca |
|
|
|
|
|
|
(1)金属性最强的元素是 (填元素名称);
(2)第三周期中,最高价氧化物水化物酸性最强的是 (填化学式);
(3)C和N中,原子半径较小的是 ;
(4)Si是带来人类文明的重要元素之一,其氧化物常用于制造 (填一种高性能的现代通讯材料的名称);
(5)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 。
Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。

I.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。(要求:左上角的第一个格是第一周期第IA族元素)
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X__________,Y__________,M__________。
(2)请写出N元素在周期表中的位置 周期、 主族;与N同族的短周期元素L,其最高价氧化物的电子式为 ;N的最高价氧化物与NaOH溶液反应离子方程式: 。
(3)Y与Z的最高价氧化物的水化物的酸性强弱 (用化学式表示)Y与Z相比,非金属性较强的元素是__________,可以证明该结论的实验是(用化学方程式表示) 。
A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 |
结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是 ;A与E形成的化合物的电子式是 。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是 。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是 。
(4)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是 。
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和上图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。a是 ;b是 。
②合金中A元素的质量分数是 (用含m、a、b的式子表示)。
本题分为选做题(a)、(b)两道平行题,分值一样,可根据高一课程学习情况选择其中一道题完成作答,若二道题均作答,则按(a)题给分。
(a)有H、N、O、Na、Cl五种短周期主族元素。
(1)写出氯离子的原子结构示意图________,写出水分子的电子式________。
(2)NH4NO3是_______化合物(填“离子”或“共价”)。
(3)氯气是有毒气体,写出用饱和氢氧化钠溶液吸收氯气的离子方程式:_____________。
(4)金属元素铁是中学化学常见元素,将铁单质浸入氯化铁溶液中,该反应的离子方程式为__________。
(5)请依据(4)中的反应,设计一个原电池。要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出电极反应式。
正极反应式:___________________,负极反应式:___________________。
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
在原子序数1—18号元素中,按要求用合适的化学用语填空
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_____________。
(6)电子数为10的分子(写5个)
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________。
(2)这五种元素原子半径从大到小的顺序为 (填元素符号)。
(3)元素的非金属性Z______Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有______(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为__________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为 。
(7)若使A按下列途径完全转化为F:
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。
(8分)A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)E元素在周期表的位置是
(3)A的最高价氧化物与NaOH溶液反应的离子方程式为 。
(4)加热条件下,D的单质与足量B的最高价氧化物的水化物的浓溶液反应,生成D的最髙价含氧酸,写出此反应的化学方程式: 。
(5)化合物甲由元素A、B组成,具有良好电绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分 子中含有10个电子,写出该反应的化学方程式: 。
有A、B、C、D四种短周期主族元素,其原子序数依次增大。A、B可形成A2B和A2B2两种共价化合物,B、C同主族且可形成CB2和CB3两种化合物。完成下列问题。
(1)C的名称为________
(2)写出表示非金属性C<D的化学方程式(任一个):________ 。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为___________。
(4)请依据(4)中的反应,设计一个原电池。要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出负极反应式。
负极反应式:____________________。
I(1)某同学做如下实验,以检验反应中的能量变化。
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):
能设计成原电池的反应是____________________________________________。
II(1)有下列几种物质
A.金刚石和石墨
B.C2H6和C5H12
C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2
E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是________;属于同系物的是________;属于同位素的是________。
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
III:(1)C7H16名称
(2)指出下列反应的类型
乙烯使酸性高锰酸钾溶液褪色:_________________
(3)写出反应的化学方程式:三氯甲烷与氯气在光照下反应_________________
下图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是 (用离子符号表示)。
(3)有两种离子化合物,均由①、④、⑤、⑧四种元素组成,这两种物质可在水溶液中发生反应。写出该反应的离子方程式: 。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族) ;
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行。B的化学式为 。
X的化学式可能为(写出不同类物质) 或 。
原子序数由小到大排列的四种短周期元素X、Y、 Z、W, 四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M完全燃烧生成的氧化物的电子式________,该氧化物与水反应的离子方程式________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为_______。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是_______(填化学式)。写出该气体B与氯水反应的离子方程式____________________。
(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。C的化学式为______________________________。
下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是 (填元素符号),其离子结构示意图为 。
(2)写出②的氢化物的电子式: ,该氢化物的水溶液显______(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式: 。
(3)最高价氧化物对应的水化物中碱性最强的是 ,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为: 。
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式: ;该化合物含有化学键类型有: ;
写出该物质暴露空气中变质的化学方程式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂。X是一种氢化物,常温下为液体。则:
(1)写出A的晶体中存在的作用力有: ;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨。写出气体C与气体Y反应的化学方程式: ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2 L(标况下),则反应过程中转移的电子数为 。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_________________________________(填元素符号)。
(3)元素的非金属性Z____Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有____(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为____________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为_______;
(7)若使A按下列途径完全转化为F:
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。