(共13分)下表列出了a-f六种元素在周期表前三周期的位置。
| |
|
a |
|||||
| |
|
|
|
b |
c |
|
|
| d |
|
e |
|
|
|
f |
|
请回答下列问题:
(1)c元素的名称是 ,d元素位于 族。
(2)用元素符号表示六种元素中,性质最稳定的元素 , 元素的原子半径最大。
(3)非金属性b c(填“大于”“小于”)
(4)用化学式表示最高价氧化物属于两性氧化物的是 ,最高价氧化物对应水化物酸性最强的是
(5)写出e元素单质与NaOH反应的离子方程式
用电子式表示化合物df的形成过程 。
下表为元素周期表的一部分,请回答有关问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑦的元素符号是__________和__________;
(2)表中最活泼的金属是__________,非金属最强的元素是__________(填写元素符号);
(3)表中能形成两性氢氧化物的元素是__________,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:
__________________________________________________,
__________________________________________________,
(4)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:_____________________。
A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称________________;
(2)A、B形成的化合物的电子式___________________________;
(3)C的元素符号________,C的最高价氧化物的化学式_________________________;
(4)B的最高价氧化物对应水化物的浓溶液与单质Cu反应的化学方程式为____ ________
下图是元素周期表的一部分,针对表中的①⑩种元素,用元素符号或化学式回答相关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
|
① |
|
② |
|
| 三 |
③ |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
| 四 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 。
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 。
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为 。
⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为 。
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为 。
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式 。
下表给出14—17号元素的一些性质,请回答:
| |
14Si |
15P |
16S |
17Cl |
| 单质与H2 反应的条件 |
高温 |
磷蒸气与 H2能反应 |
加热 |
光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 |
H4SiO4 弱酸 |
H3PO4 中强酸 |
H2SO4 强酸 |
HClO4 最强含氧酸 |
(1)它们所形成的氢化物中稳定性最差的是 ,还原性最差的是 。
(2)四种元素的非金属性随着元素原子序数的递增而逐渐 ,试从原子结构的角度加以解释 。
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由 。
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题:
(1)B在元素周期表中的位置是 。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是 。
E、F元素最高价氧化物对应水化物之间反应的离子方程式为 。
(3)E在D2中燃烧生成化合物X,则X的电子式是: 。
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金即可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。
I.下列各组物质:
① 、
、 、
、 ②石墨和C60 ③水和冰
②石墨和C60 ③水和冰
④正戊烷和异戊烷 ⑤35Cl2、37Cl2
其中,
(1)属于同分异构体的是 (填序号,下同)
(2)属于同素异形体的是
(3)属于同位素的是
II.下列6种固态物质:①P4 ②SiO2 ③NH4Cl ④NAF ⑤CO2(干冰) ⑥金刚石,
回答下列问题:
(1)熔化时不需要破坏化学键的化合物是 (填序号,下同)
(2)熔化时需要破坏共价键的单质是
(3)含有共价键的离子化合物是
X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X ,Y ,M 。
(2)请写出下列反应的离子方程式:N单质与NaOH溶液反应: 。
(3)Y与Z相比,非金属性较强的元素是 (填元素符号),可以证明该结论的实验是(用离子方程式表示) 。
现有X、Y、Z、W四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布。X没有正价态的化合物;Y的氢化物为H2Y;0.2mol的Z原子能从酸中置换出2.24LH2(标准状况);W的原子核内没有中子。
(1)X、Y、Z三种元素的名称依次为________,________,________。
(2)用电子式表示Z与X相互结合成化合物的过程:______________________ 。
(3)写出Z与Y所形成的1∶1型化合物跟W与Y所形成的化合物作用的离子方程式_________。
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,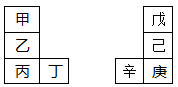
(1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(2)用元素符号表示辛、己、戊的原子半径从大到小的顺序 ;
(3)丙与庚的原子核外电子数相差 ;
(4)戊单质电子式为 ,写出一种含戊、己两种元素的离子化合物的化学式 。
下列递变规律不正确的是
| A.Na.Mg、Al还原性依次减弱 |
| B.I2、Br2、Cl2氧化性依次增强 |
| C.原子半径:F<Mg<K |
| D.稳定性:PH3>H2S> HCl |
下表是元素周期表的一部分。
已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
(1)⑧的元素符号是 。
(2)⑤与As两种元素中,非金属性较强的是 (填元素符号)。
(3)用化学符号表示②⑤⑥⑦四种元素的简单离子半径由大到小是 。
(4)元素③与②的最高价氧化物对应的水化物反应的化学方程式是______________。
(5)若A为红棕色气体,则A、X、D的化学式分别为 、 、 。
(6)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的碱性溶液反应,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子。该反应的离子方程式为 。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 。
(3)D的单质与水反应的方程式为_ 。
(4)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。