下表列出了A-R9种元素在周期表中的位置
| 周期/族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
E |
|
F |
|
|
| 3 |
A |
C |
D |
|
|
|
G |
R |
| 4 |
B |
|
|
|
|
|
H |
|
(1)这九种元素中:化学性质最不活泼的是 ;金属性最强的是: ,非金属性最强的是: ,最高价氧化物的水化物碱性最强的碱的电子式 ,最高价氧化物的水化物酸性最强的酸是 ;氢化物稳定性最差的是
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为 ,离子半径顺序为: 。
(4)F的最常见氢化物的电子式 ;该氢化物在常温下跟B发生反应的化学方程式是 ,剧烈程度 (填大于、小于、等于)A。
(5)C元素跟G元素形成的化合物的电子式是 ,用电子式表示其形成过程为 。
(6) G元素和H元素,A元素和B元素核电荷数之差分别为 。
下表列出了周期表短周期中6种元素的有关数据:
| 元素编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 原子半径(nm) |
0.075 |
0.110 |
0.152 |
0.071 |
0.186 |
0.099 |
| 最高价态 |
+5 |
+5 |
+1 |
0 |
+1 |
+7 |
| 最低价态 |
﹣3 |
﹣3 |
0 |
﹣1 |
0 |
﹣1 |
根据上表信息填空:
(1)写出下列编号对应元素的元素符号:② ,③ .
(2)元素④在周期表中的位置是 .
(3)元素⑤形成的两种常见氧化物的化学式分别为 、 ,其中都含有的化学键是 .
(4)①的氢化物和⑥的氢化物反应的化学方程式为 .
(8分)现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是________;元素①②④⑦的气态氢化物中最稳定的是________(填化学式);
(2)上述元素形成的单核离子中半径最大的是________,半径最小的是________;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式_____;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式___________。
(9分)(1)R原子的3p轨道上只有一个未成对电子,则R原子可能是_______、_______;X原子在第二层上只有一个空轨道,则X是________;Y原子的核电荷数为33,其外围电子排布是________,其在元素周期表中的位置是________,是属于________区的元素。
(2)某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小的,其核外电子排布式为__________________,价电子构型为________,属于________区元素。
四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素, B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是__________。
(2)化合物CA3的电子式是______________。
(3)BD2与淡黄色固体反应生成D2的反应方程式:_____________________。
(4)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为__________。
(1)X的基态原子核外有3个原子轨道充满电子,其价电子排布式为________
(2)M+中3d能级的轨道在半充满状态其原子的电子排布式为________
(3)E元素原子核外有6种不同运动状态的电子,其最高价氧化物的分子的结构式为______,该分子中σ键与π键个数之比为 ,写出与该分子互为等电子体的分子的化学式为 。
(1)写出氯原子的原子结构示意图 ,NH4Cl的电子式 ;
(2)用电子式表示H2O的形成过程 ;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量 (填“高”、“低”),故白磷比红磷稳定性 (填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷, 放出热量多。
(1)写出砷的元素符号 ,原子中所有电子占有______个轨道,核外共有_________个不同运动状态的电子。
(2)写出Ni的元素名称 ,该元素在周期表的位置为第 周期,第 族。
(3)第四周期基态原子中未成对电子数最多的元素是 ,该元素基态原子的价电子轨道表示式为 。
(4)第三电子层上有________个能级,作为内层最多可容纳_______个电子,作为最外层时,最多可含有______个未成对电子。
写出有关的元素符号
(1)某元素最外层电子数是次外层电子数的2倍,该元素符号是 。
(2)某元素次外层电子数是最外层电子数的2倍,该元素符号是 。
(3)某元素K层与M层电子数相同,该元素符号是 。
有W、X、Y、Z四种原子序数依次增大的元素。已知:
①W与X或Y形成的化合物的焰色反应均呈黄色
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z的3d轨道上有电子,可与Y组成化合物ZY2和ZY3
请回答:
(1)W是 ,X是 ,Y是 。(填元素符号)
(2)Z元素在元素周期表中的位置是第 周期 族,Z3+的核外电子排布式为: 。
(3)W2X的电子式为 。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
|
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑦元素的离子半径 S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置 ;在这些元素中,化学性质最不活泼的是 。(填元素符号)比较③与⑥的氢化物, 更稳定(填化学式)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)比较①与⑤的最高价氧化物对应的水化物, 的酸性强(填化学式);用相应的化学方程式证明 。
(4)实验室制取②的氢化物的化学方程式 ;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为: (用化学方程式表示)
(5)写出④的单质与水反应的离子方程式 。
(1)元素A是第三周期ⅦA族元素,A元素与另两种非金属元素可组成离子化合物甲。写出甲的化学式________。
(2)在所有的气态氢化物中,元素B的氢化物最稳定,写出元素B在周期表中的位置_________。
(3)金属元素C形成的某化合物的溶液常用于检验CO2,则元素C的简单离子与元素A的简单离子的半径大小关系是________ (用离子符号表示),元素D的原子序数比元素C小8,写出元素D的单质在CO2中燃烧的化学方程式________ 。
(4)元素E是第三周期中简单离子半径最小的元素,元素F是第三周期中原子半径最大的元素,写出元素E的单质与元素F的最高价氧化物对应水化物反应的的离子方程式________________ 。
(12分)某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、镁、铝各0.2mol分别投入到100mL的1mol/L盐酸中,试预测实验结果:
______与盐酸反应最剧烈,___与盐酸反应的速度最慢;_____与盐酸反应产生的气体体积最多(同状况下)。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律: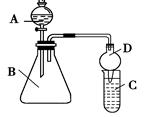
(2)仪器A的名称为_____,干燥管D的作用为_________。
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____的现象,即可证明。有的同学认为该实验设计不够严密,则应在B、C两装置间添加装有________溶液的洗气瓶。
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
| a |
|
|
|||||
| |
|
|
d |
f |
g |
|
|
| b |
|
c |
e |
|
|
h |
|
请回答下列问题:
(1)g与a可形成化合物a2g,试写出它的结构式 ,常温下,将b的单质投入a2g中,发生反应的离子方程式为 。
(2)d、f、e三种元素最高价氧化物对应的水化物的酸性由弱到强的顺序为(用化学式表示) 。
(3)b的最高价氧化物的水化物与单质c反应的离子方程式 ,该反应 (填“能”或“不能”)作为设计原电池的反应原理。
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104 kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。