福建省漳浦县三校高二下学期期中化学试卷
下列叙述正确的是
| A.分子晶体中的每个分子内一定含有共价键 |
| B.金属晶体的熔点和沸点都很高 |
| C.离子晶体中可能含有共价键 |
| D.原子晶体中的相邻原子间只存在非极性共价键 |
某离子晶体的晶胞结构如图所示:则该离子晶体的化学式为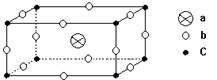
| A.abc | B.abc3 | C.ab2c3 | D.ab3c |
下列各原子或离子的电子排布式错误的是
| A.Si 1s22s22p2 | B.O2– 1s22s22p6 |
| C.Na+ 1s22s22p6 | D.Al 1s22s22p63s23p1 |
共价键、离子键和范德华力是构成物质时粒子间的不同作用力,下列物质中,只含有上述一种作用力的是
| A.干冰 | B.氯化钠 | C.氢氧化钠 | D.碘 |
对于SO2和CO2的说法中正确的是
| A.都是直线形结构 |
| B.中心原子都采用SP杂化轨道 |
| C.SO2为V形结构,CO2为直线形结构 |
| D.S原子和C原子上都没有孤对电子 |
下列表达方式错误的是
A.甲烷的电子式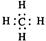 |
B.氟化钠的电子式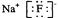 |
| C.硫离子的核外电子排布式 1s22s22p63s23p4 |
D.碳12原子 C C |
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaH2;⑥白磷(P4),其中含有两种结合力的组合是
| A.①③⑤⑥ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |
下列关于元素周期表和元素周期律的说法错误的是
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐增强 |
| C.因为Al比Mg失去电子数多,所以Al比Mg的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石.②晶体硅.③碳化硅中,它们的熔点从高到低的顺序是
A.①③② B.②③① C.③①② D.②①③
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
对于H3O+的下列说法中正确的是
| A.O原子采用SP2杂化 | B.O原子采用SP3杂化 |
| C.离子中不存在配位键 | D.离子中存在非极性键 |
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
500 |
4600 |
6900 |
9500 |
| Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1
B.元素X与氯形成化合物时,化学式可能是XCl
C.元素Y是ⅢA族元素
D.若元素Y处于第三周期,它可与冷水剧烈反应
下列事实与氢键有关的是
| A.水结成冰体积膨胀,密度变小 |
| B.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 |
| C.He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 |
| D.水加热到很高的温度都难以分解 |
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体。它的分子是三角锥形,以下关于PH3的叙述正确的是
| A.PH3是非极性分子,难溶于水 |
| B.PH3的熔沸点高于NH3,极易被液化 |
| C.PH3稳定性弱于NH3,是因为NH3分子间还存在氢键 |
| D.PH3分子中有未成键的孤对电子 |
据报道,在40GPa高压下,用激光器加热到1800K,科学家已成功合成出CO2原子晶体,下列有关这种CO2晶体推断正确的是
| A.易液化,可用作制冷材料 |
| B.CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 |
| C.硬度很大,可用作耐磨材料 |
| D.在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
| C.[Cu(NH3)4] 2+的空间构型为正四面体型 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
有下列八种晶体:
| A.水晶(SiO2) |
| B.冰醋酸 |
| C.氧化镁 |
| D.白磷 |
E.晶体氩
F.氯化铵
G.铝
H.金刚石。
用序号回答下列问题:
(1)属于原子晶体的化合物是 ,直接由原子构成的分子晶体是 。
(2)含有共价键的离子晶体是 ,只含离子键的是 。
(3)在一定条件下能导电而不发生化学键断裂的是 ,受热熔化后化学键不发生变化的化合物是 ,受热熔化后需克服共价键的是 。
现有几组物质的熔点(℃)数据:
| A组 |
B组 |
C组 |
D组 |
| 金刚石:>3 550 |
Li:181 |
HF:-84 |
NaCl:801 |
| 硅晶体:1 410 |
Na:98 |
HCl:-115 |
KCl:776 |
| 硼晶体:2 300 |
K:64 |
HBr:-89 |
RbCl:718 |
| 二氧化硅:1 723 |
Rb:39 |
HI:-51 |
CsCl:645 |
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的粒子间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①硬度大 ②导电性 ③导热性 ④延展性
(3)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(4)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为: 。
有W、X、Y、Z四种原子序数依次增大的元素。已知:
①W与X或Y形成的化合物的焰色反应均呈黄色
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z的3d轨道上有电子,可与Y组成化合物ZY2和ZY3
请回答:
(1)W是 ,X是 ,Y是 。(填元素符号)
(2)Z元素在元素周期表中的位置是第 周期 族,Z3+的核外电子排布式为: 。
(3)W2X的电子式为 。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号