辽宁省葫芦岛市高一下学期省五校协作体期中化学试卷
下列反应属于放热反应的是:
①稀硫酸与氢氧化钾溶液反应
②锌与稀硫酸的反应
③生石灰变成熟石灰的反应
④氢氧化钡晶体和氯化铵晶体混合反应
⑤石灰石高温煅烧
⑥灼热的炭与CO2反应
⑦甲烷与O2的燃烧反应
| A.①②③⑤ | B.①②③⑦ | C.①②⑤⑥⑦ | D.④⑥ |
关于原子结构、元素性质的说法正确的是:
| A.随原子序数的递增,元素原子的核外电子数逐渐增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同 |
| D.电子层结构相同的微粒,其化学性质一定相似 |
H2与O2发生反应的过程用模型图示如下(“-”表示化学键):下列说法不正确的是: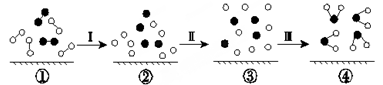
| A.过程Ⅰ是吸热过程 |
| B.过程Ⅲ一定是放热过程 |
| C.该反应过程所有旧化学键都断裂,且形成了新化学键 |
| D.该反应的能量转化形式只能以热能的形式进行 |
25 ℃、101 kPa下:
①2Na(s)+1/2O2(g)====Na2O(s) ΔH1="-414" kJ·mol-1
②2Na(s)+O2(g)====Na2O2(s) ΔH2="-511" kJ·mol-1
下列说法正确的是:
| A.①和②产物的阴阳离子个数比相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.0 ℃、101 kPa ,1molNa在O2中完全燃烧放出255.5KJ的热量 |
X、Y、Z和R分别代表4种元素。如果aXm+、bYn+、cZn-、dRm-4种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是:
| A.a-c=m-n | B.a-b=n-m | C.c-d=m+n | D.b-d=n+m |
已知:C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)====C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)====H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为:
| A.4a+4b+4c | B.2a-2b+6c | C.2a-2b+2c | D.2a-6b+2c |
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是: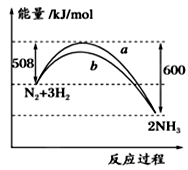
| A.加入催化剂,不能改变该化学反应的反应热 |
| B.b曲线是加入催化剂时的能量变化曲线 |
C.该反应的热化学方程式为:N2(g)+3H2(g)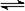 2NH3(g) ΔH=-92 kJ/mol 2NH3(g) ΔH=-92 kJ/mol |
| D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
下列说法中,不正确的是:
| A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 |
| B.第三周期元素的离子半径大小比较:Cl->S2->Na+>Mg2+>Al3+ |
C.日本福岛核电站释放出的放射性核素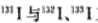 互为同位素 互为同位素 |
| D.相同条件下,测定同浓度的H2CO3溶液和H2SO4溶液的酸性,可比较C和S的非金属性强弱 |
下表是元素周期表中的一部分,表中所列字母分别表示一种元素。(选项中的物质都由下表中的元素组成)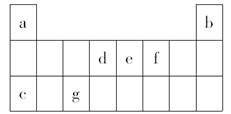
由以上信息可推断下列说法正确的是:
| A.宇航员在飞船活动舱内会产生d和f组成的气体,吸收这种气体的化合物应该由e和f组成 |
| B.活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质 |
| C.c和f以原子个数之比为1:1组成的化合物可用作宇航员所需f单质的来源 |
| D.《阿凡达》中潘多拉星球上存在32b,地球上此元素主要以42b形式存在,32b比42b少一个质子 |
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是:
| A.同周期的主族元素中,第ⅦA族元素的原子半径最小 |
| B.元素周期表中从第ⅢB族到第ⅡB族十个纵列的元素都是金属元素 |
| C.第ⅥA族元素的原子,其半径越大,气态氢化物越稳定 |
| D.室温下,0族元素的单质都是气体 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是: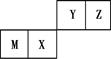
| A.原子半径Z<M |
| B.Y的最高价氧化物对应水化物的酸性比X的弱 |
| C.X的最简单气态氢化物的热稳定性比Z的小 |
| D.Z位于元素周期表中第2周期第ⅥA族 |
天然存在的金属钫(Fr)极微量。它的21种已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是:
| A.在空气中燃烧时生成氧化物Fr2O |
| B.在碱金属元素中具有最大的原子半径 |
| C.氧化物对应的水化物是极强的碱 |
| D.其单质的熔点比金属钠的熔点低 |
下列叙述错误的是:
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H= -114.6kJ·mol-1 则中和热为57.3kJ·mol-1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
| A.②④⑥ | B.①⑤⑥ | C.②③④ | D.①⑤⑦ |
如下表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是: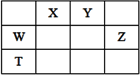
| A.X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B.由X、Y和氢三种元素形成的化合物中一定只有共价键 |
| C.W、X、Z三种元素最高价氧化物对应水化物的酸性逐渐减弱 |
| D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
下列有关热化学方程式的书写及对应的表述均正确的是:
| A.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量。则Fe(s)+S(s)==="FeS(s)" ΔH=-95.6 kJ·mol-1 |
| B.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1 |
| C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 |
| D.已知2C(s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则C的燃烧热ΔH=-110.5 kJ·mol-1 |
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是: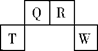
| A.R的氧化物在空气中与其它物质作用可形成光化学烟雾 |
| B.常温下丁的浓溶液可用T单质所制的容器来盛装 |
| C.丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 |
| D.甲、乙、丙、丁受热均易分解 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性且稳定性弱于HF |
| B.Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱 |
| C.Z的氢化物的水溶液在空气中存放不易变质 |
| D.X和Z的最高价氧化物对应的水化物都是弱酸 |
有Wn+、Xm+、Ym-、Zn-(m>n)四种离子,且W、X、Y、Z四种原子的M电子层中的电子数均为奇数。下列说法中正确的是:
| A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大 |
| B.Y、Z的气态氢化物的热稳定性:HmY>HnZ |
| C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 |
| D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
以下反应中,ΔH 1 >ΔH 2的是:
| A.S(s)+O2(g) → SO2(g) ΔH1 S(g)+O2(g) → SO2(g) ΔH 2 |
| B.2H2(g)+O2(g) → 2H2O(l)ΔH 1 2H2(g)+O2(g) → 2H2O(g)ΔH 2 |
| C.NaOH(aq)+HCl(aq) → NaCl(aq)+H2O(l)ΔH 1 NaOH(aq)+CH3COOH(aq) →CH3COONa(aq)+H2O(l)ΔH 2 |
| D.H2(g)+F2(g) → 2HF(g)ΔH 1 |
H2(g)+Cl2(g) → 2HCl(g) ΔH 2
(一)实验方法测定反应热---------中和热测定
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热△H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。△H=
(3)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,此反应所用NaOH溶液的浓度应为 mol/L。
(二)通过化学计算间接获得
(1)已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H= kJ·mol-1
(2)已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为 kJ·mol-1;
下表列出了周期表短周期中6种元素的有关数据:
| 元素编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 原子半径(nm) |
0.075 |
0.110 |
0.152 |
0.071 |
0.186 |
0.099 |
| 最高价态 |
+5 |
+5 |
+1 |
0 |
+1 |
+7 |
| 最低价态 |
﹣3 |
﹣3 |
0 |
﹣1 |
0 |
﹣1 |
根据上表信息填空:
(1)写出下列编号对应元素的元素符号:② ,③ .
(2)元素④在周期表中的位置是 .
(3)元素⑤形成的两种常见氧化物的化学式分别为 、 ,其中都含有的化学键是 .
(4)①的氢化物和⑥的氢化物反应的化学方程式为 .
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为____________________________________________。
(2)又知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________。
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素符号 |
元素性质或原子结构 |
| A |
A是形成化合物最多的元素 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 ;
(2)B的最简单气态氢化物分子空间构型 ;其沸点高于同主族的其它气态氢化物原因 ;
(3)D的最高价氧化物对应水化物的化学键类型 ;
(4)B、C、D、E简单离子半径大小 (用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式 ,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式 .
 粤公网安备 44130202000953号
粤公网安备 44130202000953号