在工农业生产和日常生活中经常用到的物质有下列几种:①Si②NH4Cl③Ca(ClO)2④Al(OH)3⑤Fe2O3。其中:电脑芯片中常用的物质是__________(填序号,下同);用于杀菌、消毒的物质 是____________;用作化肥的是____________;用作红色油漆和涂料的是___________;医用胃酸中和剂的是 _____________。
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。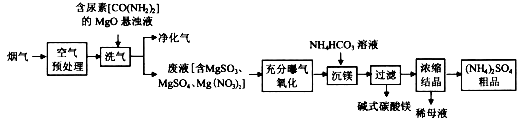
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
Na2O2可作为潜水艇里氧气的来源。将3.9gNa2O2充分反应。
(1)Na2O2的物质的量为_________mol。
(2)生成的O2在标准状况下的体积为___________L。
(3)反应中转移的电子数为________(NA为阿伏加德罗常数的值)。
用化学用语表达下列变化过程,其中(1)~(3)写化学方程式,(4)~(5)写离子方程式。
(1)金属钠与水反应______________________
(2)工业合成氨____________________________
(3)二氧化硫与硫化氢反应___________________________
(4)碳酸氢钠溶液与稀盐酸反应_______________________
(5)少量氯气通入碘化钾溶液中_______________________
掺杂微量铜、硼、镓、硒等元素的单晶硅太阳能电池是第三代太阳能电池之一。
(1)Cu2+的电子排布式为___________________。
(2)已知铜转化为水合离子过程如下:
已知I1=745.5kJ/mol,I2=1957.3kJ/mol。在水溶液中Cu2+比Cu更稳定的原因是_____________。
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2。1mol(SCN)2含有π键的数目为_______________。HSCN有两种结构,H-S-C≡N(硫氰酸)的沸点低于H-N=C=S(异硫氰酸)的沸点,其原因是_________________。
(4)BF3能与NH3反应生成配合物BF3-NH3,该配合物中B原子的杂化方式为___________________。
(5)铜和硒可形成的半导体团簇分子的球棍模型如图所示,其分子式为__________________。
(6)镓与某有机物形成的配合物过程如下图,在图上画出产物中的配位键。
(7)与Si同周期部分元素的电离能如下图所示,其中a、b和c分别代表_____________。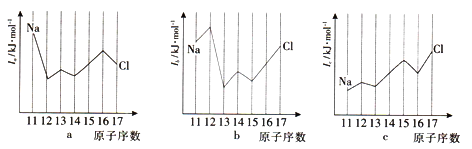
| A.a为I1、b为I2、c为I3 | B.a为I2、b为I3、c为I1 |
| C.a为I3、b为I2、c为I1 | D.a为I1、b为I3、c为I2 |
Ⅰ.由苯乙烯制得的聚苯乙烯可用于制造一次性餐具。
(1)苯乙烯的分子式为_______________。
(2)苯乙烯制取聚苯乙烯的化学方程式为______________________。
Ⅱ.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”。为此人们开发出一种聚乳酸塑料来替代聚苯乙烯。聚乳酸合成过程如下:
(3)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是( )
| A.互为同分异构体 | B.水解最终产物相同 |
| C.纤维素是纯净物 | D.均是高分子化合物 |
(4)乳酸分子中所含官能团有_________________(填名称)。
(5)根据结构推断聚乳酸可能发生的反应类型是______________,并据此说明用聚乳酸塑料替代聚苯乙烯塑料的好处是_____________。
(6)乳酸与足量Na反应的化学方程式为____________________。
氮元素可形成丰富多彩的物质。
(1)基态氮原子的价电子轨道表示式为______________;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为___________________。
(2)光化学烟雾易在PM2.5尘粒的催化作用下形成,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是__________________。
| A.N2O与CO2互为等电子体,其结构式为N=N=O |
| B.O3的沸点大于O2 |
| C.CH2=CHCHO分子中碳原子的杂化方式为sp2、sp3 |
| D.HCOOH在水中溶解度大的原因与氢键有关 |
(3)在配合物中,下列微粒NH3、NH4+、NH2OH不能作为配位体的有____________。
(4)图a为六方氮化硼晶体结构示意图,该晶体中存在的作用力有______________。

(5)六方氮化硼在高温高压下可转化为立方氮化硼,其晶胞结构如图b,晶胞边长为dcm,该晶胞中含有_________个氮原子、__________个硼原子,立方氮化硼的密度是__________g·cm-3(阿伏伽德罗常数的值为NA)
海水提镁的工业流程如下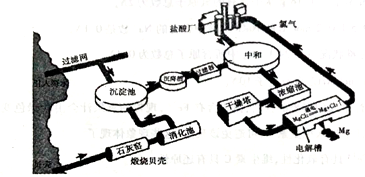
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2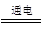 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
制造普通玻璃的主要原料是(写名称)_________、________、__________。
有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥乙烯使溴的四氯化碳溶液褪色
⑦实验室制乙烯 ⑧由甲苯制取TNT
⑨溴乙烷和氢氧化钠的乙醇溶液共热
⑩乙苯的制备: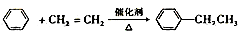
(1)其中属于取代反应的是__________;属于氧化反应的是_________;属于加成反应的是_________;属于消去反应的是_________;属于聚合反应的是___________
(2)写出⑧和⑨的化学方程式:
⑧____________________________________
⑨____________________________________
某学习小组共同学习乙醛的化学性质,以下是他们的学习过程,请填空:
(1)根据乙醛的结构对性质进行预测
| 乙醛的结构特点 |
可能的化学性质 |
有 双键,不饱和 双键,不饱和 |
与H2发生 反应,乙醛表现 性 |
 CHO中C-H键极性较强 CHO中C-H键极性较强 |
 CHO中C—H键被氧化,变为C—OH CHO中C—H键被氧化,变为C—OH |
(2)写出乙醛与氢气反应的方程式
(3)设计实验验证乙醛的还原性,请填全表格。
| 实验 |
现象 |
结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 |
|
乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 |
试管壁上出现 |
乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 |
|
乙醛被氢氧化铜氧化 |
根据上表及所学知识回答:
①乙醛被高锰酸钾溶液氧化为 (填结构简式)
②写出乙醛发生银镜反应的方程式
(4)某有机物只含C、H、O三种元素,该有机物对氢气的相对密度为15,完全燃烧 0.1mol该有机物生成4.4gCO2和1.8gH2O,该有机物的分子式为 ,若红外光谱显示该分子中有醛基,则3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量为 g
(1)根据官能团对下列有机物进行分类,将它们的类别填写在横线上。
(2)在①HC≡CH②C2H5Cl,③CH3CH2OH,④CH3COOH,⑤聚乙烯,⑥ 六种物质中:
六种物质中:
①能与溴水发生化学反应是________;②属于高分子化合物的是________;
③能与Na2CO3溶液反应的是________;④能发生酯化反应的是________;
⑤能发生消去反应的是。
(3)下图中A、B、C分别是三种有机物分子的表示方法:
请回答下列问题:
①A、B两种模型分别是有机物的________模型和________模型。
②A、B、C三种有机物中,所有原子均共面的是________(填字母序号)。
③有机物C具有的结构或性质是________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构
b.有特殊气味、有毒、易溶于水、密度比水大
c.一定条件下能与液溴发生取代反应
d.能与浓硝酸发生氧化反应
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下: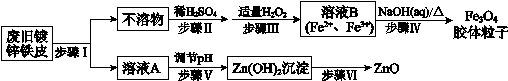
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。