数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果。已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 ;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为 。
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) === HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) === CH3OH(g) +CO(g) △H>0
则以甲醇制一氧化碳的反应为 反应(填“吸热”、“放热”)。
(4)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4。

①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(5)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 。

有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 。
(2)下列物质中,一定条件下能与A发生反应的是 。
a.H2 b.Na c.酸性KMnO4溶液 d.Br2
(3)A的结构简式是 。
(4)有机物B是A的同分异构体,能发生银镜反应,1 mol B最多能与2 mol H2加成。B中所有碳原子一定处于同一个平面,请写出所有符合条件的B的结构简式(不考虑立体异构) 、 。
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
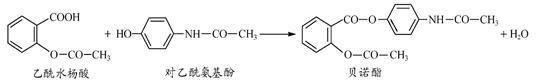
(1) 贝诺酯分子式为
(2) 对乙酰氨基酚在空气易变质,原因是 。
(3) 用浓溴水区别乙酰水杨酸和对乙酰氨基酚,方案是否可行 (填“可行”或“不可行”)。
(4)写出乙酰水杨酸与足量氢氧化钠溶液反应的化学方程式 。
(5)实验室可通过两步反应,实现由乙酰水杨酸制备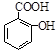 ,请写出两步反应中依次所加试剂的化学式 、 。
,请写出两步反应中依次所加试剂的化学式 、 。
下图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素。
(1)该有机物的分子式为_____________________________;
(2)往该有机物溶液中滴入FeCl3溶液,可以看到溶液呈紫色,可以确定该有机物的结构简式为_______;
(3)该有机物与浓溴水反应的方程式为_______________________________;
(4)往该有机物的水溶液一般呈白色浑浊状,往溶液中滴入NaOH溶液,现象是______________,反应方程式为_______________________。
在北方,常用乙二醇作内燃机的抗冻剂。某种合成乙二醇的路径如下图所示:
(1)按先后顺序,依次完成上图中每步反应的化学方程式:
①_______________________________________
②_______________________________________
③_______________________________________
(2)一定条件下,乙二醇可以被氧化为乙二醛,反应方程式为:______________________________
(3)CH2BrCH2Br有一同分异构体,其结构简式为:______________________________
家庭使用的天然气主要成分是甲烷,液化石油气的主要成分为丙烷。
(1)将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是________(写化学式,下同),在所有生成物中,和甲烷分子一样具有正四面体结构的物质是___________;
(2)液化石油气燃烧的主要化学方程式为__________________________;现有一套以天然气为原料的灶具,欲改为烧液化石油气,需要对灶具进行改装的措施是:_______________空气进量(填“增大”或“减小”);
(3)丙烷可以认为是丙烯的加成产物,也可以认为是某块的加成产物,该炔是_________(写结构简式);
(4)丙烯跟溴起加成反应,标准状况下,11.2L丙烯可以与________gBr2完全反应。
(1)请用系统命名法给下列有机物予以命名:
① ______________________
______________________
②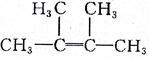 ________________________
________________________
(2)请写出下列化合物的结构简式:
①3-乙基-2-戊醇 _______________________________
有NaHSO4、Ba(OH)2、NaHCO3三种溶液,已知其中两种溶液的物质的量浓度相同,且分别为另一种溶液的物质的量浓度的2倍;若先将 NaHSO4和NaHCO3溶液各100mL混合反应后,再加入Ba(OH)2溶液100mL,充分反应后,将生成的白色沉淀滤出,得300mL滤液,测得滤液中只含NaOH溶质,其物质的量的浓度为 0.9 mol·L-1(不考虑混合时引起的溶液体积的变化),试回答下列问题:
(1)写出Ba(OH)2溶液与过量NaHCO3溶液反应的离子方程式: ;
(2)写出NaHSO4溶液和NaHCO3溶液反应的离子方程式: ;
(3)通过分析,判断原Ba(OH)2、NaHSO4、NaHCO3三种溶液中哪两种溶液的物质的量浓度不可能相同?(填化学式)。
(4)题中NaHCO3溶液的浓度可能为 。
用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
(1)光导纤维的主要成分是 ;
(2)目前应用最多的太阳能电池的光电转化材料是 ;
(3)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类具有均匀微孔结构的被称为 (物质类别)的化合物。
(4)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为 ;
(5)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为 ;用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为 。
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应SO2(g)+NO2(g)  SO3(g)+NO(g),测得上述反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
SO3(g)+NO(g),测得上述反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
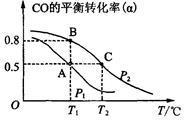
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。A、B两点对应的压强大小关系是PA PB(填“大于”、 “小于”或“等于”)。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的排列顺序是 (填序号),其中由水电离出的H+浓度最小的是 (填序号)。
(2)③中各离子浓度由大到小的顺序是 ,该温度下②中NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)该温度下向③中通入少量氨气,此时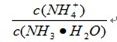 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”)。
工业合成氨反应的能量变化如图所示。

(1)写出合成氨反应的热化学方程式:
(2)在甲乙两个体积均为2L固定容积的密闭容器中,分别充入甲:1molN2、3molH2和乙:1molN2、3molH2、1molHe,(其它条件相同),反应速率甲 乙(填大于、小于或等于),经过足够长的时间后在甲容器中该反应放出的热量(或吸收的热量) 92.4kJ(填“大于”、 “小于”或“等于”)
(3)下列图像分别代表焓变(△H )、混合气体平均相对分子质量(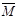 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

(1)室温下,以惰性电极电解100 mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式 ;若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(2)25℃时,在浓度均为1mol/L的三种溶液:a (NH4)2SO4、b (NH4)2CO3、c (NH4)2Fe(SO4)2中,c(NH4+)由大到小的顺序是 (用a、b、c表示)
(3)已知反应2HI(g) = H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为______________kJ。
某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。用盐酸滴定待测液NaOH,滴定终点时的颜色变化是 ;若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值 (填“无影响”、“偏高”或“偏低”)。
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
(1)工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 。
(2)铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3+ + 3S2O82-+ 7H2O=Cr2O72-+ 6SO42-+ 14H+
②Cr2O72-+ 6I-+ 14H+=2Cr3+ + 3I2 + 7H2O
③I2 + 2S2O32-=2I-+ S4O62-