(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是_________。(填序号)
① NaAlO2 ② Ca(OH)2 ③Na2CO3 ④Al(OH)3
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗掉的Na、Mg、Al的物质的量之比为______________。
(4)足量的Al分别与等浓度的硫酸溶液、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为______________。
I.下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t 1 |
t 2 |
| 水的离子积 KW |
1×10-14 |
1×10-13 |
1×10-12 |
试回答以下问题:
(1)25℃下,某 Na2SO4溶液中 c(SO42-)=5×10-4 mol∙L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=____________。
(2)在 t 2℃下,将 a mol∙L-1CH3COOH 溶液与 b mol∙L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=____________(用 a、b 表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
②2Ag+(aq)+2OH-(aq)  Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
(3)写出 Ag2O溶于氨水(用 NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;
计算 25℃下,该反应的平衡常数(用 c、d 表示)K =____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
| 离子 |
Mg2+ |
Cr3+ |
Cl- |
| 浓度(mol/L) |
0.5 |
0.01 |
a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的 a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节 pH 的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是___________________。
根据下列化合物:①H2SO4②CH3COOH③NaCl④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦(NH4)2SO4⑧Na2C2O4⑨NH4HSO4,回答问题:
(1)⑧溶液中,盐水解的离子方程式________________________。
(2)已知水存在如下平衡:H2O+H2O H3O++OH-,现欲使平衡向左移动,且所得溶液显酸性,可加入的试剂是上述中的__________。
H3O++OH-,现欲使平衡向左移动,且所得溶液显酸性,可加入的试剂是上述中的__________。
(3)浓度均为0.1mol∙L-1的③⑤溶液比较:c(Na+)__________c(NH4+)。浓度均为0.1mol∙L-1的③⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3∙H2O)=__________。
(4)物质的量浓度相同的①②③④⑤⑥六种稀溶液,按pH由大到小的顺序为(填序号)________。
(5)pH相同的⑤、⑦、⑨三种稀溶液中,c(NH4+)的顺序是(填序号)__________。
(6)pH均为4 ,等体积的①和②溶液分别加水稀释 n倍、m倍,稀释后两种溶液的 pH都变成 6,则 m________n(填 “<”、“>”或“=”)。
(7)常温下,使溶液⑤中,c(NH4+) =c(Cl-)的操作是_____________________。
综合治理空气污染是环境化学当前主要研究的内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂条件下可转化为 N2(g)和 CO2(g)得到净化。
①已知2NO(g)+2CO(g)  N2(g)+2CO2(g) 反应能自发进行,则该为__________反应(填“吸热”或“放热”)。
N2(g)+2CO2(g) 反应能自发进行,则该为__________反应(填“吸热”或“放热”)。
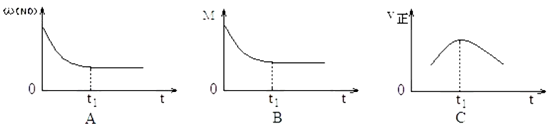
②上述反应在绝热、恒容密闭容器中进行,并在 t1时可达到平衡(图中 ω、M、v正分别表示质量分数混合气体平均相对分子质量和正反应速率),则下列示意图中符合题意的是__________(填选项序号)。
(2)在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

③NO的转化率为__________,0~15min 内,v(NO) =__________。
④20min 时若改变反应条件,导致CO浓度下降,则改变的条件可能是__________(填选项序号)。
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容气体积
⑤如图所示,无摩擦、无质量的活塞 1、2 将反应器隔成甲、乙两部分,在 25℃、101kPa 下实现平衡时,各部分体积分别为 V甲、V乙。此时若去掉活塞1,不引起活塞2的移动,则X =__________, V甲:V乙=__________。

有机物A为饱和多元醇,将13.6g A在20.0L纯O2(过量)中充分燃烧并使反应后的气体依次缓缓通过浓硫酸和碱石灰后,测得气体体积分别为17.76L和6.56L(所有气体体积均在标准状况下测定)。A的分子式为 。又知A中含有2种氢原子,则A的结构简式为 。
一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:

(1)80-90ml对应反应的离子方程式 。
(2)金属铝的质量为 g。
(3)盐酸的体积是 ml。
(4)a的取值范围是 。
BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s) + 3C(s) + 3Cl2(g)  2BCl3 (g) + 3CO(g)。
2BCl3 (g) + 3CO(g)。
(1)反应起始至3min时固体质量减少了15.9克,则氯气的平均反应速率为_____________。
(2)反应至4min时达到平衡,则下列说法正确的是____________(填序号)。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
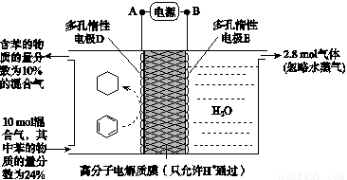
①A、D之间导线中电子移动方向为_______________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
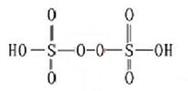
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物_________________;
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列_________________;
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_________________;
(4)Se原子基态核外电子的排布式为_________________;
(5)SO32-离子中硫原子的杂化方式__________,该离子的立体构型为____________;
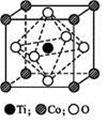
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示。

①在一个晶胞中,X离子的数目______,该化合物的化学式为______________;
②Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 ;
③Y与Z可形成YZ42-。YZ42-的空间构型为_________(用文字描述);写出一种与YZ42-互为等电子体的分子的化学式____________;
④X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为________;
I(1)在MgCl2溶液中滴加少量NaOH溶液,现象为______________,继续加入过量的NaOH溶液,现象为________________。
(2)在AlCl3溶液中滴加少量NaOH溶液,现象为_________________,所发生反应的离子方程式为________________________,继续加入过量的NaOH溶液,现象为___________,所发生反应的离子方程式为___________。
II将下列现象或用途中硫酸所表现出来的性质填写在空白处。
(1)把锌粒放入稀硫酸中时,有气体放出,_____________________。
(2)浓硫酸能够用于干燥某些气体,___________________________。
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑,_______________________。
(4)把木炭放入热的浓硫酸中时,有气体放出,_____________________。
III漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂。
(1)在常温下,将氯气通入NaOH溶液中制取漂白液的化学方程式为:____________。
(2)漂白粉或漂粉精的有效成分是___________,使用漂白粉或漂粉精时通常要加入少量的水并通入CO2,此操作方法的目的是:_____________________________。
I将一小块钠投入CuSO4溶液中,观察到的现象是____________(填序号)。
①钠浮于液面上;②熔化成小球;③发出嘶嘶的响声,放出气体;④有蓝色沉淀产生;⑤析出大量红色的铜;⑥小球在溶液中沉浮;⑦小球在液面上游动、逐渐变小,直至消失。请用离子方程式解释实验现象_______________________ __。
II完成下列反应的化学方程式或离子方程式:
(1)铁粉与水蒸气反应化学方程式:______________________________________。
(2)铝与氢氧化钠溶液反应化学方程式:_______________ _________________。
(3)锌粒与氯化铜溶液反应离子方程式:__________________ ______________。
根据下面的反应路线及所给信息填空。
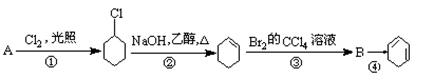
(1)A的结构简式是_____________,名称是_____________。
(2)②的反应类型_____________,③的反应类型_____________。
(3)反应④的化学方程式 。
苹果酸是一种常见的有机酸,其结构简式为:
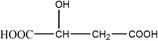
(1)苹果酸含有的官能团名称是__________、__________,在一定条件下,苹果酸可发生化学反应的类型有 (填序号)。
a.水解反应 b.缩聚反应 c.加聚反应 d.中和反应
(2)写出苹果酸与足量金属钠发生反应的化学方程式:__________________________。
(3)1mol苹果酸与足量碳酸钠充分反应生成的气体在标准状况下体积为__________。
下列有机化合物中,有的有多个官能团:

(1)可以看作醇类的是(填入编号,下同) 。
(2)可以看作酚类的是 。
(3)可以看作羧酸类的是 。
(4)可以看作酯类的是 。
氮及其化合物之间可以互相转化,请按照要求回答下列问题:
(1)实验室制取氨气。
① 实验室制取氨气的反应原理是利用了 类物质与 类物质的反应。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中, 会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:氨的催化氧化:____________。
② 体现N元素的氧化性:____________。