某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、OH-离子中的一种或几种,现通过以下实验进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,
(3)向上述溶液中加入BaCl2溶液,无现象。
据此可以判断该待测液中一定大量存在的离子是 ,一定不能大量存在的离子是 ,不能确定是否存在的离子是 ,依次写出(2)中加入氢氧化钠后的离子反应: , 。
有一瓶无色澄清溶液,其中可能含有Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子。现进行以下实验:
①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变成碱性,无沉淀产生;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
(1)根据上述事实确定:
该溶液中肯定存在的离子有 ;
肯定不存在的离子有 ;
可能存在的离子有 。
(2)写出③中发生反应的离子方程式 。
(3)检验该溶液中所含的阴离子的试剂是 (填名称)。
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用水煤气合成二甲醚,总反应为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=﹣246.4kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是 (填字母代号).
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓度
(2)该反应的化学平衡常数表达式K= .温度升高平衡常数(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3mol H2、3mol CO、1mol CH3OCH3、1mol CO2,在一定温度和压强下发生反应:
3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.问:①反应开始时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②平衡时n(CH3OCH3)= ,平衡时CO的转化率为 .
③在该反应条件下能判断反应达到化学平衡状态的依据是 (填编号).
| A.v(CO)=3v(CO2) |
| B.生成a mol CO2的同时消耗3a mol H2 |
| C.c(CO2)=c(CO) |
| D.混合气体的平均相对分子质量不变 |
E.气体的密度不再改变
F.气体的总质量不再改变
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 Ti和
Ti和 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是

(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
| A.苯与B3N3H6互为等电子体 |
| B.甲醛、苯分子中碳原子均采用sp2杂化 |
| C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |
硫-氨热化学循环制氢示意图如下:

(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g), H=+177kJ•mol-1……(a)
H=+177kJ•mol-1……(a)
2SO3(g) 2SO2(g) + O2(g),
2SO2(g) + O2(g), H="+196" kJ•mol-1……(b)
H="+196" kJ•mol-1……(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。

i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
PbI2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如下:
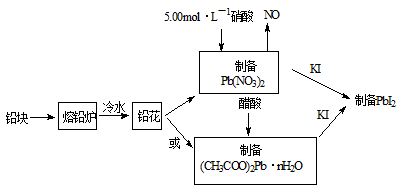
(1)将铅块制成铅花的目的是 。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸 mL,同时产生 L(标准状况下)NO。
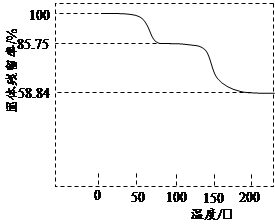
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率
随温度的变化如下图所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n= (填数字)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为 (写结构简式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。计算室温时PbI2的Ksp (请给出计算过程)。
丹参酮ⅡA是一种治疗心血管疾病的药物,其中的一种合成路线如下:

(1)丹参酮ⅡA中含氧官能团为 和 (写名称)。
(2)试剂X的分子式为C5H11N,则X的结构简式为 。
(3)C→D的反应类型为 。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.能发生银镜反应
Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢
(5)写出以CH3CH=CHCH3和CH2=CHCHO为原料制备 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:

CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:

(1)步骤①发生的反应离子方程式为 。

(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填:1∶2;3∶7;2∶3)外,另一目的是 。
(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度 D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: 甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
(1)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(2)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是: 。

在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3—、NO3—。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的_____________离子,还可能含有大量的________离子。
(2)若溶液和铝粉反应后有Al3+生成则溶液中一定含有大量的________离子,原溶液中一定不含有大量的________离子。
四川盛产五倍子。以五倍子为原料可以制得化合物A。A的结构简式如下图所示:
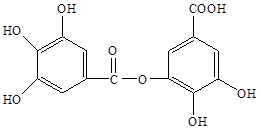
请回答下列问题:
(1)A中有哪些官能团(写出名称)_______。
(2)有机物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________。
(3)1molA最多能消耗 molNaOH;请写出A与过量的NaOH溶液反应的化学方程式________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看做是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能使溴水褪色。请写出C与溴水反应的化学方程式________。
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 Ti和
Ti和 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是

(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
| A.苯与B3N3H6互为等电子体 |
| B.甲醛、苯分子中碳原子均采用sp2杂化 |
| C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |
以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程如下:

(1)碱熔时,下列措施有利于NH3逸出的是 。
a.升温 b.加压 c.增大NaOH溶液浓度
(2)滤渣主要成分为Mg3(PO4)2、MgSiO3,已知Ksp[Mg3(PO4)2] = 6.4×10-26,Ksp(MgSiO3) = 2.3×10-5。若滤液中c(PO43-)≤10-6 mol·L-1,则c(Mg2+)至少为 mol·L-1。
(3)由图可知,加入一定量的MgSO4溶液作沉淀剂。随着温度升高,除磷率下降,其原因是Mg3(PO4)2溶解度增大、 ;随着温度升高,除硅率增大,其原因是 (用离子方程式表示)。

(4)沉钒时,反应温度需控制在50℃,在实验室可采取的措施为 。在此温度和pH=8的最佳条件下,探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10 mL一定浓度的滤液A和B,分别加入1 mL和 10 mL的1 mol·L-1NH4Cl溶液,向 , 控制两份溶液温度均为50℃、pH均为8,由专用仪器测定沉钒率。(忽略混合过程中溶液体积的变化)
(5)高纯的偏钒酸铵灼烧可制备新型光电材料V2O5,该反应的化学方程式为 。
电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO- 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1 FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2 mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④ 该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。