电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO- 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1 FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2 mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④ 该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。




 80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们
80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们 的重视,水体中的无机汞主要有Hg2+、Hg22+。
的重视,水体中的无机汞主要有Hg2+、Hg22+。 +可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为: 。
+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为: 。 吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI
吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: 。
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: 。 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出. __.
__. 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________. A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)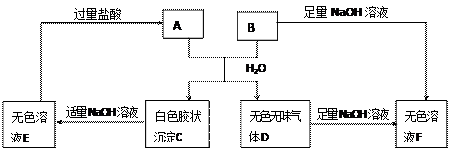
 粤公网安备 44130202000953号
粤公网安备 44130202000953号