2019年全国统一高考理综试卷(全国Ⅲ卷)化学部分
化学与生活密切相关。下列叙述错误的是( )
A. 高纯硅可用于制作光感电池 B. 铝合金大量用于高铁建设
C. 活性炭具有除异味和杀菌作用 D. 碘酒可用于皮肤外用消毒
下列化合物的分子中,所有原子可能共平面的是( )
| A. | 甲苯 |
B. | 乙烷 |
C. | 丙炔 |
D. | 1,3−丁二烯 |
X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A. 熔点:X的氧化物比Y的氧化物高 B. 热稳定性:X的氢化物大于Z的氢化物
C. X与Z可形成离子化合物ZX D. Y的单质与Z的单质均能溶于浓硫酸
离子交换法净化水过程如图所示。下列说法中错误的是( )
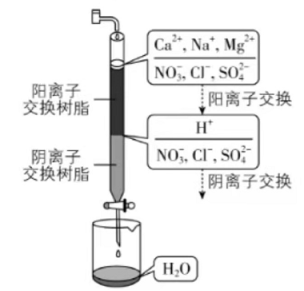
| A. | 经过阳离子交换树脂后,水中阳离子的总数不变 |
| B. | 水中的 、 、 通过阴离子树脂后被除去 |
| C. | 通过净化处理后,水的导电性降低 |
| D. | 阴离子树脂填充段存在反应 |
设
为阿伏加德罗常数值。关于常温下pH=2的
溶液,下列说法正确的是( )
A. 每升溶液中的 数目为
B.
C. 加水稀释使电离度增大,溶液pH减小
D. 加入 固体,溶液酸性增强
下列实验不能达到目的的是( )
选项 |
目的 |
实验 |
A |
制取较高浓度的次氯酸溶液 |
将 通入碳酸钠溶液中 |
B |
加快氧气的生成速率 |
在过氧化氢溶液中加入少量 |
C |
除去乙酸乙酯中的少量乙酸 |
加入饱和碳酸钠溶液洗涤、分液 |
D |
制备少量二氧化硫气体 |
向饱和亚硫酸钠溶液中滴加浓硫酸 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn-NiOOH二次电池,结构如下图所示。电池反应为
。下列说法错误的是( )
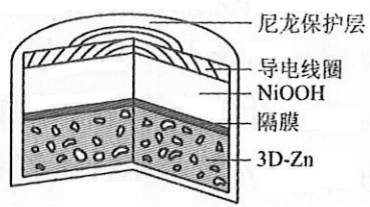
| A. |
三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 |
| B. |
充电时阳极反应为 |
| C. |
放电时负极反应为 |
| D. |
放电过程中 通过隔膜从负极区移向正极区 |
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
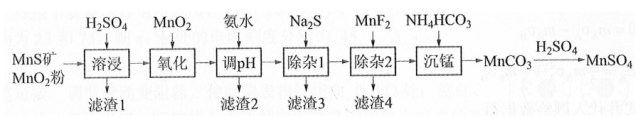
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
|
|
|
开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
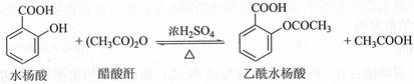
水杨酸 |
醋酸酐 |
乙酰水杨酸 |
|
熔点/℃ |
157~159 |
-72~-74 |
135~138 |
相对密度/(g·cm ﹣ 3) |
1.44 |
1.10 |
1.35 |
相对分子质量 |
138 |
102 |
180 |
实验过程:在 锥形瓶中加入水杨酸 及醋酸酐 ,充分摇动使固体完全溶解。缓慢滴加 浓硫酸后加热,维持瓶内温度在 左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
| A. |
热水浴 |
| B. |
酒精灯 |
| C. |
煤气灯 |
| D. |
电炉 |
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的________(填名称)。
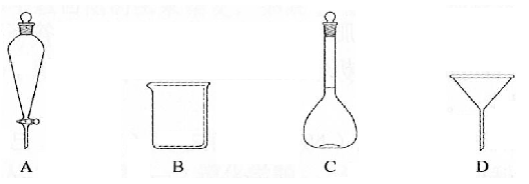
(3)①中需使用冷水,目的是________。
(4)②中饱和碳酸氢钠的作用是________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为________。
(6)本实验的产率是________%。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
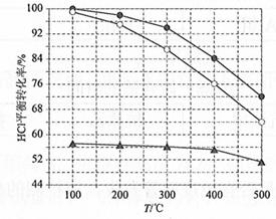
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
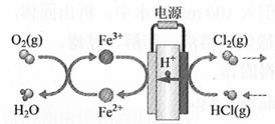
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
【选修三:物质结构与性质】磷酸亚铁锂(
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
、
、
和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填"相同"或"相反")。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为________,其中Fe的配位数为________。
(3)苯胺 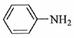 )的晶体类型是________。苯胺与甲苯(
)的晶体类型是________。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4) 中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5) 和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
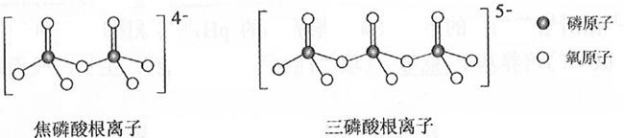
这类磷酸根离子的化学式可用通式表示为________(用 n代表P原子数)。
【选修五:有机化学基础】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:

回答下列问题:
(1)A的化学名称为________。
(2) 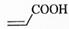 中的官能团名称是________。
中的官能团名称是________。
(3)反应③的类型为________,W的分子式为________。
(4)不同条件对反应④产率的影响见下表:
实验 |
碱 |
溶剂 |
催化剂 |
产率/% |
① |
KOH |
DMF |
|
22.3 |
② |
|
DMF |
|
10.5 |
③ |
|
DMF |
|
12.4 |
④ |
六氢吡啶 |
DMF |
|
31.2 |
⑤ |
六氢吡啶 |
DMA |
|
38.6 |
⑥ |
六氢吡啶 |
NMP |
|
24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③ 的X与足量金属Na反应可生成 。
(6)利用Heck反应,由苯和溴乙烷为原料制备 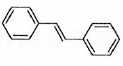 ,写出合成路线________。(无机试剂任选)
,写出合成路线________。(无机试剂任选)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号