由短周期元素组成的 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)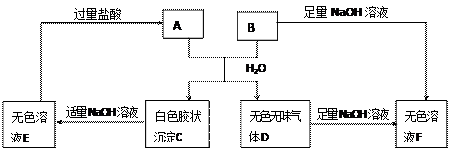
(1)A和B的混合物溶于水发生反应的离子方程式______________________________.
(2)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式__________________________________________________.
由短周期元素组成的 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(1)A和B的混合物溶于水发生反应的离子方程式______________________________.
(2)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式__________________________________________________.