(1)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①上述两种解释中________(填“甲”或“乙”)正确。
②为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
③若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知25 ℃时CH3COONH4溶液呈中性)
(2)有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙同学在制得的Mg(OH)2沉淀中加入浓CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
甲同学的解释为:因为NH4Cl溶液中,NH4++H2O NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s) Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
乙同学的解释为:因为CH3COONH4===CH3COO-+NH4+,且Mg(OH)2(s) Mg2+(aq)+2OH-(aq),NH4++OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
Mg2+(aq)+2OH-(aq),NH4++OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
你认为哪一位同学的解释是正确的?________,为什么?____________________。
 H++A2-。
H++A2-。
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。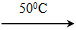 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q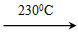 Ni(s)+4CO(g)
Ni(s)+4CO(g) 粤公网安备 44130202000953号
粤公网安备 44130202000953号