空气中 含量的控制和 资源利用具有重要意义。
(1)燃煤烟气中 的捕集可通过如图所示的物质转化实现。

“吸收”后所得的 溶液与石灰乳反应的化学方程式为__________;载人航天器内,常用 固体而很少用 固体吸收空气中的 ,其原因是__________。
(2)合成尿素 是利用 的途径之一。尿素合成主要通过下列反应实现
反应Ⅰ:
反应Ⅱ:
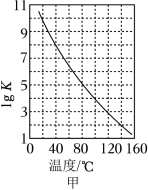
①密闭体系中反应Ⅰ的平衡常数( )与温度的关系如图甲所示,反应Ⅰ的 _____(填“ ”或“ ”或“ ”)。
②反应体系中除发生反应Ⅰ、反应Ⅱ外,还发生尿素水解、尿素缩合生成缩二脲[ ]和尿素转化为氰酸铵( )等副反应。尿素生产中实际投入 和 的物质的量之比为 ,其实际投料比值远大于理论值的原因是_______________。
(3)催化电解吸收 的 溶液可将 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率( )随电解电压的变化如图乙所示。
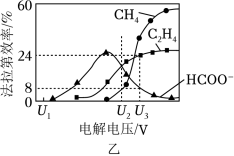
其中, , 表示电解生成还原产物 所转移电子的物质的量, 表示法拉第常数。
①当电解电压为 时,电解过程中含碳还原产物的 为 ,阴极主要还原产物为_____(填化学式)。
②当电解电压为 时,阴极由 生成 的电极反应式为__________。
③当电解电压为 时,电解生成的 和 的物质的量之比为_____(写出计算过程)。
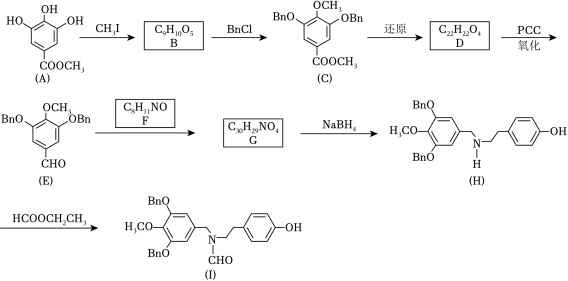
加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如图。
已知:①
为
②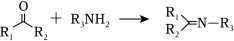 (
为烃基,
为烃基或
)
(
为烃基,
为烃基或
)
回答下列问题:
(1)A中与卤代烃成醚活性高的羟基位于酯基的_____位(填“间”或“对”)。
(2)C发生酸性水解,新产生的官能团为羟基和_____(填名称)。
(3)用 代替 完成D→E的转化,化学方程式为_____。
(4)F的同分异构体中,红外光谱显示有酚羟基、无 键的共有_____种。
(5)H→I的反应类型为_____。
(6)某药物中间体的合成路线如图(部分反应条件已略去),其中M和N的结构简式分别为_____和_____。
硫酸工业在国民经济中占有重要地位。
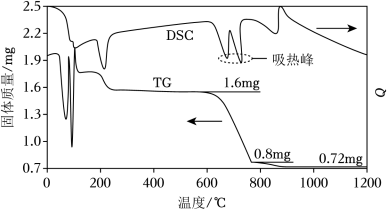
(1)我国古籍记载了硫酸的制备方法——“炼石胆( )取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及 曲线(反映体系热量变化情况,数值已省略)如图所示。 左右有两个吸热峰,则此时分解生成的氧化物有 、_____和_____(填化学式)。
(2)铅室法使用了大容积铅室制备硫酸( 以下),副产物为亚硝基硫酸,主要反应如下:
ㅤ
(i)上述过程中 的作用为_____。
(ii)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是__________(答出两点即可)。
(3)接触法制硫酸的关键反应为 的催化氧化:
(i)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率( )下反应速率(数值已略去)与温度的关系如图所示,下列说法正确的是_____。
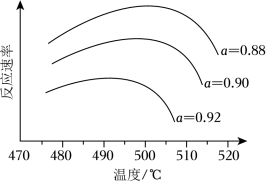
| A. |
温度越高,反应速率越大 |
| B. |
的曲线代表平衡转化率 |
| C. |
越大,反应速率最大值对应温度越低 |
| D. |
可根据不同 下的最大速率,选择最佳生产温度 |
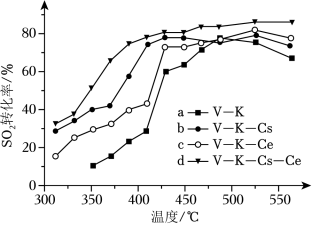
(ii)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_____(填标号)。
(iii)设 的平衡分压为 , 的平衡转化率为 ,用含 和 的代数式表示上述催化氧化反应的 _____(用平衡分压代替平衡浓度计算)。
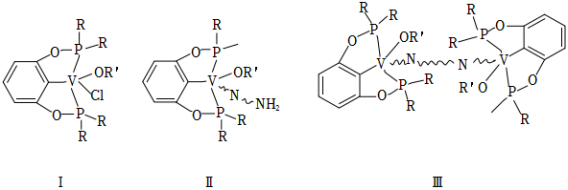
我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
( 代表单键、双键或三键)
代表单键、双键或三键)
回答问题:
(1)配合物Ⅰ中钒的配位原子有 种,它们是_____。
(2)配合物Ⅰ中, 代表芳基, 空间结构呈角形,原因是__________。
(3)配合物Ⅱ中,第一电离能最大的配位原子是_____。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为 和 ,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是_____。
(5)近年来,研究人员发现含钒的锑化物 在超导方面表现出潜在的应用前景。 晶胞如图1所示,晶体中包含由 和 组成的二维平面(见图2)。
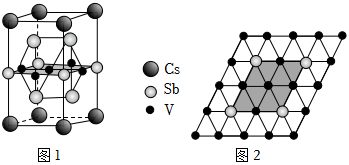
①晶胞中有 个面的面心由钒原子占据,这些钒原子各自周围紧邻的锑原子数为_____。锑和磷同族,锑原子基态的价层电子排布式为_____。
②晶体中少部分钒原子被其它元素(包括 )原子取代,可得到改性材料。下列有关替代原子说法正确的是_____。
| A. |
有 或 价态形式 |
| B. |
均属于第四周期元素 |
| C. |
均属于过渡元素 |
| D. |
替代原子与原离子的离子半径相近 |
[化学--选修5:有机化学基础]
化合物G是治疗高血压的药物"比索洛尔"的中间体,一种合成G的路线如下:
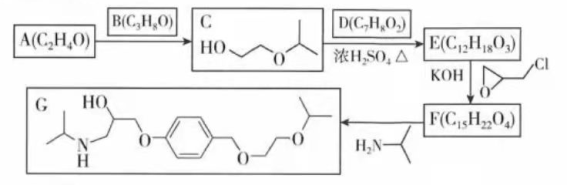
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢; 可与 或 反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G的分子式为____________。
(6)L是D的同分异构体,可与FeCl 3溶液发生显色反应, 的L可与 的 反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
【选修五:有机化学基础】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:

回答下列问题:
(1)A的化学名称为________。
(2)  中的官能团名称是________。
中的官能团名称是________。
(3)反应③的类型为________,W的分子式为________。
(4)不同条件对反应④产率的影响见下表:
| 实验 |
碱 |
溶剂 |
催化剂 |
产率/% |
| ① |
KOH |
DMF |
|
22.3 |
| ② |
|
DMF |
|
10.5 |
| ③ |
|
DMF |
|
12.4 |
| ④ |
六氢吡啶 |
DMF |
|
31.2 |
| ⑤ |
六氢吡啶 |
DMA |
|
38.6 |
| ⑥ |
六氢吡啶 |
NMP |
|
24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③ 的X与足量金属Na反应可生成 。
(6)利用Heck反应,由苯和溴乙烷为原料制备  ,写出合成路线________。(无机试剂任选)
,写出合成路线________。(无机试剂任选)
【选修五:有机化学基础】
环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:

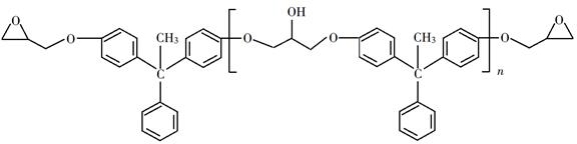
已知以下信息:

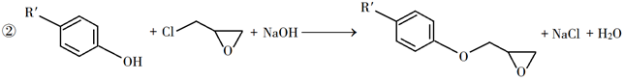
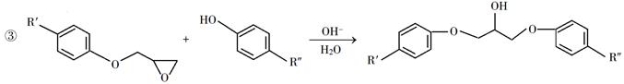
回答下列问题:
(1)A是一种烯烃,化学名称为________,C中官能团的名称为________、________。
(2)由B生成C的反应类型为________。
(3)由C生成D的反应方程式为________。
(4)E的结构简式为________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式________、________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H 2O的总质量为765g,则G的 n值理论上应等于________。
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
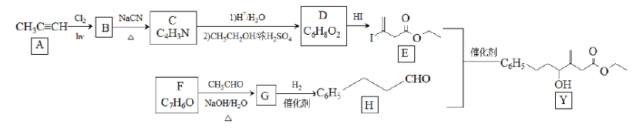
已知: 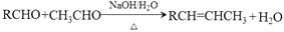
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________。
以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。有葡萄糖为原料合成E的路线如下:
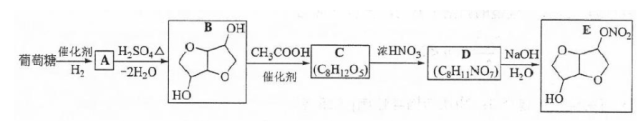
回答下列问题:
(1)葡萄糖的分子式为________.
(2)A中含有的官能团的名称为________.
(3)由B到C的反应类型为________.
(4)C的结构简式为________.
(5)由D到E的反应方程式为________.
(6)F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为________.
端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应. 该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线:
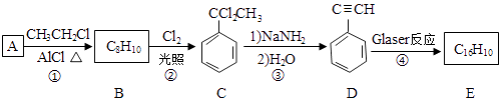
回答下列问题:
(1)B的结构简式为________,D的化学名称为________.
(2)①和③的反应类型分别为________、________.
(3)E的结构简式为________.用 合成1,4﹣二苯基丁烷,理论上需要消耗氢气________mol.
(4)化合物(________)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为________.
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式________.
(6)写出用2﹣苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线________.
以硅藻土为载体的五氧化二钒( )是接触法生产硫酸的催化剂.从废钒催化剂中回收 既避免污染环境又有利于资源综合利用.废钒催化剂的主要成分为:
| 物质 |
|
|
|
|
|
|
| 质量分数/% |
2.2~2.9 |
2.8~3.1 |
22~28 |
60~65 |
1~2 |
<1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)"酸浸"时 转化为 , 反应的离子方程式为________,同时 转成 . "废渣1"的主要成分是________.
(2)"氧化"中欲使 的 变为 , 则需要氧化剂 至少为________mol.
(3)"中和"作用之一是使钒以 形式存在于溶液中."废渣2"中含有________.
(4)"离子交换"和"洗脱"可简单表示为: (以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈________性(填"酸""碱""中").
(5)"流出液"中阳离子最多的是________.
(6)"沉钒"得到偏钒酸铵( )沉淀,写出"煅烧"中发生反应的化学方程式________.
卤沙唑仑 是一种抗失眠药物,在医药工业中的一种合成方法如图:
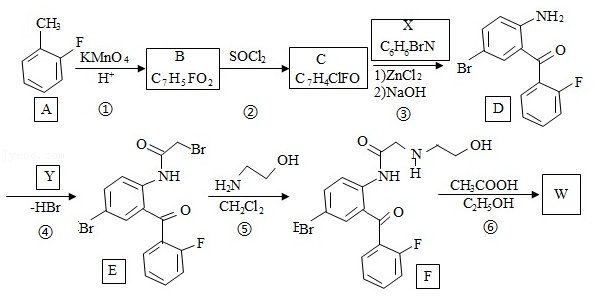
已知:(ⅰ)  +
+ 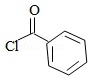
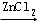
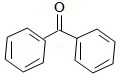 +HCl
+HCl
(ⅱ)  +
+ 
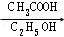
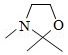 +H 2O
+H 2O
回答下列问题:
(1) 的化学名称是 。
(2)写出反应③的化学方程式 。
(3) 具有的官能团名称是 。(不考虑苯环)
(4)反应④中, 的结构简式为 。
(5)反应⑤的反应类型是 。
(6) 的同分异构体中,含有苯环并能发生银镜反应的化合物共有 种。
(7)写出 的结构简式 。
维生素E是一种人体必需的脂溶性维生素,现已广泛应用于医药、营养品、化妆品等。天然的维生素E由多种生育酚组成,其中α﹣生育酚(化合物E)含量最高,生理活性也最高。下面是化合物E的一种合成路线,其中部分反应略去。

已知以下信息:
a) 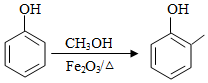
b) 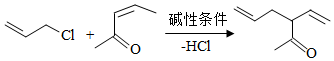
c) 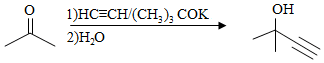
回答下列问题:
(1)A的化学名称为 。
(2)B的结构简式为 。
(3)反应物C含有三个甲基,其结构简式为 。
(4)反应⑤的反应类型为 。
(5)反应⑥的化学方程式为 。
(6)化合物C的同分异构体中能同时满足以下三个条件的有 个 (不考虑立体异构体,填标号)。
(ⅰ)含有两个甲基;(ⅱ) 含有酮羰基(但不含C=C=O); (ⅲ) 不含有环状结构。
(a) 4 (b) 6 (c) 8 (d) 10
其中,含有手性碳(注:连有四个不同的原子或基团的碳)的化合物的结构简式为 。