硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为: 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤 、 。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为 。
下图中的实验装置可以用于实验室制取乙炔。请填空: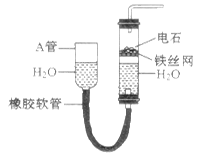
(1)图中A管的作用是 ,制取乙炔的化学反应方程式为 。
(2)乙炔通入酸性KMnO4溶液中,发生 反应,可以观察到的现象为 ,
若通入溴水中,发生 反应,反应方程式为 。
(3)乙炔燃烧的化学方程式为 ,燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 。
镁橄榄石主要成分是Mg2SiO4,电解法促进镁橄榄石固定CO2的工艺流程如下图所示:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
固碳时主要反应的方程式为NaOH(aq)+CO2(g)=NaHCO3(aq)。
(1)上图方框里的操作名称是 ,横线上的物质有(填化学式) 。
(2)下列物质中也可用作“固碳”的是(填字母序号) 。
| A.CaCl2 | B.NH3·H2O |
| C.Na2CO3 | D.H2O |
(3)由下图可知,90 ℃后曲线A溶解效率下降,分析其原因 。
(4)经分析,所得碱式碳酸镁沉淀中含有少量NaCl。为提纯,可采取的方法是 。本流程中可循环利用的物质是(填化学式) 。
(5)另一种橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为____________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为______________
(3)下列有关镓和镓的化合物的说法正确的是____________________(填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH)3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式_______________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________________________________________。
(6)净化II中加入Zn的目的是______________________________________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_______________________。已知:Ksp[Fe(OH)3] =" 8.0" × 10-38;lg5 = 0.7
硫代硫酸钠是一种常见的化工原料,将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是 。
(2)用该方法获得的Na2S2O3∙5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究。
【提出假设】该晶体中含有的杂质可能是:Na2CO3、Na2SO3、_____、_____等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为 。
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:______________
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3mol/LH2SO4、1mol/LNaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知:2 Na2S2O3∙+I2=2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L 的碘水进行多次取样滴定,测得Na2S2O3∙5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(1)纯净物根据其组成和性质可进行如下分类:
上图所示的分类方法属于 (填序号)
A.交叉分类法 B.树状分类法
下列2组物质中均有一种物质的类别与其它2种不同
A.CaO、Na2O、SiO2 B.Al(OH)3、KOH、Ba(OH)2
以上两组物质中,每组里与别的两物质的类别明显不同的物质依次是(填化学式) ; 。
写出能用离子方程式CO32- + 2H+="=" CO2↑+H2O表示的一个化学反应方程式: 。
(2)下图为实验室制取氨的实验装置。
①写出A中所发生反应的化学方程式 。
②该装置还可以制备哪些气体________。
③在收集氨时试管口棉花团的作用是 。
④收集氨气应使用___法,要得到干燥的氨气可选用___作干燥剂,检验集满的方法是 。
(19分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备: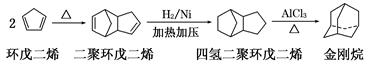
请回答下列问题:
(1)环戊二烯分子中最多有________个原子共平面;
(2)金刚烷的分子式为________,其分子中的CH2基团有________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是________,反应③的反应类型是________,
写出反应①的产物与NaOH溶液共热的化学方程式:_______________________;
反应的化学方程式:___________________________________________。
(4)已知烯烃能发生如下反应: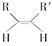
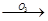
 RCHO+R′CHO
RCHO+R′CHO
请写出下列反应产物的结构简式: ___________________________________________;
___________________________________________;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出A所有可能的结构简式(不考虑立体异构):______________________________。
【改编】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:

(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式: 。
(2)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为___________________________________。
(3)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(4)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。(已知:I2+2S2O32-=2I-+S4O62-))
①滴定终点的现象是: 。
②样品中氯化铁的质量分数为 (用字母m、c、V来表示)。
(6)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+– 2e-= 2Fe3+
阴极反应为:___________________
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):_______________________

(15分)电子垃圾含70%Cu、25%Al、4%Fe以及少量Pt、Au)实验室现欲回收处理制备硫酸铜和硫酸铝晶体,合成路线如下
查阅资料获取下列信息Cu可与H2SO4、H2O2反应生成CuSO4;铁铝铜等离子沉淀为氢氧化物的PH值如表所示
请回答下列问题
(1)写出Cu与稀H2SO4、H2O2反应的离子方程式 ;
(2)操作Ⅱ中X的取值范围 ;
(3)操作Ⅲ中蒸发浓缩所需的玻璃仪器 ;
(4)操作中的滤渣生成Al2(SO4)3·18H2O的化学方程式 ;
(5)为测定CuSO4 ·5H2O晶体的纯度,取ag试样配成100ml溶液,取25.00ml,消除干扰离子后,用 b mol.L-1EDTA(Na2H2Y)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+)滴定至终点平均消耗EDTA12.00ml,则CuSO4·5H2O的纯度为 。
(16分)磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式: 。
②n越大,直链聚磷酸铵的水溶性越 (填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:
①除砷过程在75 ℃下进行,其合理的原因是 (填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是 。
③除砷过程中,合成洗涤剂起到 作用。
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式: 。
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越 (填“多”或“少”)。
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是 。
【改编】(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:

①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
【改编】MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:

(1)操作I的名称是___ __,判断固体单质A是否洗涤干净的方法是 。
(2)稀硫酸浸泡时反应的离子方程式为__________________________________;该反应中若消耗8.7g氧化剂,共转移_______mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是_______(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.使用98%的浓硫酸浸泡
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知:

写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:

①b应与直流电源的_________(填“正”或“负”)极相连。
②电解过程中氢离子的作用是______________和_____________;a电极方程式为:________________。
Ⅰ.工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2反应生成 CH4和H2O的热化学方程式 。
已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
Ⅱ.电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: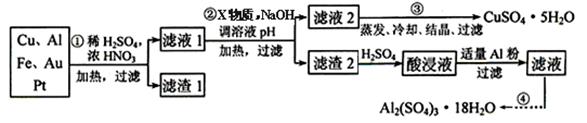
按要求回答下列问题:
(1)滤渣1中存在的金属有____________。
(2)已知沉淀物的pH如下表:
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.7 |
| Cu2+ |
4.9 |
6.7 |
| Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:________________
(4)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在 (填仪器名称)中加热脱水。
(5)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
该电池放电时负极反应式为 ,每有1mol K2FeO4被还原,转移电子的物质的量为 ,充电时阳极反应式为 。
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。