过氧化碳酰胺(CO(NN2)2·H2O2)是一种白色晶体,易溶于水和有机溶剂,稍高温度时(>45℃)即分解,可作为高效、安全、方便的固体消毒剂。工业上常用湿法合成,工艺流程如下:
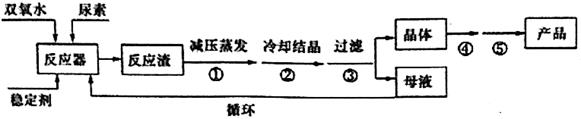
(1)反应器中发生的反应为:CO(NH2)2+H2O2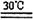 CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
(2)操作①采用减压蒸发的原因是________,操作④、⑤名称为________、________。
(3)过氧化碳酞胺也可用干法流程制取:
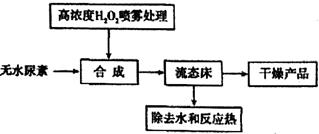
与湿法工艺对比,干法工艺的优点是________,缺点是________。
(4)为测定产品的纯度,称取3.0 g产品于锥形瓶中,加适量蒸馏水溶解,再加入几滴H2SO4,用0.2500 mol/L KMnO4标准溶液滴定,终点时消耗标准溶液40.00 mL〔己知:尿素与KMnO4溶液不反应)。
①完成并配平方程式:______MnO4-+______H2O2+ ______H+=_______Mn2 ++_____H2O+______
②产品纯度为________(结果保留到小数点后一位)。
某化工厂尝试用软锰矿、闪锌矿(含有Fe、Cu、 Al等元素杂质)联合制备工业产品MnO2和Zn。(已知:软锰矿的主要成分为MnO2,闪锌矿主要成分为ZnS。)
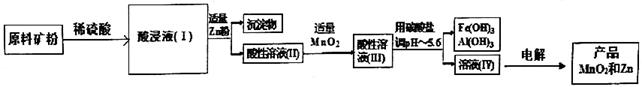
(1)原料需加工成矿粉的原因是________。
(2)己知MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,请写出原料矿粉加稀硫酸后所发生的主要反应________。
(3)酸浸液(I)中含有的金属阳离子有Mn2+、Fe3+、Zn2+、________、________。
(4)酸性溶液(II)中加入适量MnO2的作用是________;酸性溶液(Ⅲ)中所加的碳酸盐可选用________ (填序号)。
①Na2CO3 ②MnCO3 ③ZnCO3 ④CaCO3
(5)电解溶液Ⅳ后阳极产物为________,若电解过程转移lmol电子,则理论上阴极产物的质量为________g。
碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如图所示。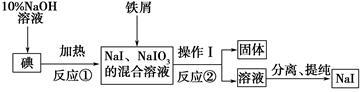
请回答下列问题。
(1)判断反应①中碘是否反应完全的方法是_______________________。
(2)操作Ⅰ的名称是_____________。
(3)反应①的离子方程式为_____________________________________。
(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是_______________;在该反应中若有99 g NaIO3被还原,则转移电子的物质的量为________mol。
氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷。某学习小组采用新的方法来制备氯气并进行性质实验。
Ⅰ.实验仪器及药品:
a.实验仪器:玻璃片、表面皿(顶部贴有湿润的蓝色石蕊试纸和干燥的石蕊试纸)、胶头滴管等
b.实验药品:KMnO4晶体、浓HCl、KBr溶液、淀粉溶液、KI溶液、FeSO4溶液、NaOH溶液、酚酞、KSCN溶液、AgNO3溶液、湿润的蓝色石蕊试纸和干燥的石蕊试纸。
Ⅱ.实验方法及图示:
①在玻璃片上分别滴加KBr溶液、FeSO4溶液、NaOH稀溶液、KI溶液、AgNO3溶液。
②在KI溶液中滴加一滴淀粉溶液
③FeSO4溶液中滴加一滴KSCN溶液
④NaOH稀溶液中滴加一滴酚酞溶液
⑤在以上溶液分布的中心放置一块KMnO4晶体,然后滴加2-3滴浓盐酸,迅速盖上表面皿。并观察实验现象。
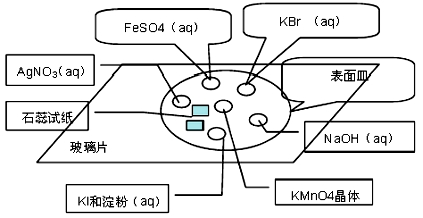
(1)该反应实验原理:2KMnO4+ 16HCl ="2KCl" +2MnCl2 +5Cl2↑+ 8H2O
该反应中氧化剂与还原剂的物质的量之比为 ;
(2)实验时反应一段时间后可以观察到KBr溶液由无色变为 色,其离子反应方程式为 ;
(3)滴有KSCN溶液的FeSO4溶液呈 色,其离子反应方程式为 、 ;
(4)滴加淀粉溶液的KI溶液呈 色,湿润的蓝色石蕊试纸的变化为 ,干燥的石蕊试纸的变化为 。
某学生课外活动小组模拟呼吸面具中的反应原理设计用图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验仪器:连接胶管及夹持装置均省略

实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。试回答:
(1)图中各装置接口连接顺序是 (填各接口的编号)。
(2)装置A的作用是 ,反应的化学方程式 。
(3)装置B的作用是 。反应的化学方程式为 。
(4)装置C中放入的反应物是 。
反应的化学方程式为 。
(5)装置D中可能发生的所有化学反应方程式为: 。
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为 (填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用 。①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用 。①NaOH ②NH3.H2O ③Cu(OH)2 ④Cu2(OH)2CO3
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应:
高纯度锰酸锂(LiMn2O4)是锂电池重要的正极材料。
(1)工业上有一种制取高纯度锰酸锂的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生的化学反应方程式:________。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750 ℃共热5 h,得到锰酸锂。请写出发生的化学反应方程式:_________。
(2)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。
把分析纯碳酸锂与球形二氧化锰两种粉末,按物质的量1:4混合均匀加热。
①升温到515 ℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723 ℃)低得多。原因是________。
②升温到566 ℃时,产生另一种气体X,X恰好与CO2物质的量相等,同时得到固体B。请写出发生的化学反应方程式:_________。
③升温到720 ℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出发生的化学反应方程式:_________。
下图是有关气体制取和性质探究的部分实验装置。

请你回答下列问题:
(1)写出图中标有字母的仪器名称:a ;b 。
(2)B装置中仪器a必须伸入液面以下的原因是 。
(3)实验室采用氯酸钾为原料制取氧气时,应选用的发生装置是 (填字母)。如图E所示,铁丝在氧气中剧烈燃烧说明氧气具有 (填“氧化性”或“可燃性”)。
(4)实验室用大理石和稀盐酸制取二氧化碳,应选用的收集装置是___ ___(填字母);此反应的化学方程式为 。
CO是一种无色、无味且不溶于水的有毒气体,其制法有:
(1)实验室可用甲酸和浓 共热制取CO.
共热制取CO.
a.甲酸和浓 应怎样混合?浓
应怎样混合?浓 起什么作用
起什么作用
b.请据实验原理选择所需主要玻璃仪器(导管除外)
c.怎样收集CO气体
(2)实验室还可用草酸晶体与浓 共热制取CO.H2C2O4
共热制取CO.H2C2O4 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
请问:怎样才能得到不含 的CO气体? _________.
的CO气体? _________.
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:________________.在此条件下,C和 的还原性谁强? _________.
的还原性谁强? _________.
回答下列问题:
(1)用乙炔制备聚氯乙烯(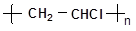 )(自行选择无机原料),
)(自行选择无机原料),
请书写化学反应方程式:_____ __;____ ____。
(2实验室用乙醇制乙烯的反应方程式为________。其反应类型为________。检验生成的乙烯要将导管先后通入______、_________。(填试剂名称)
(3)由溴乙烷为原料合成1,2-二溴乙烷(自行选择无机原料),
请书写化学反应方程式:____ ___;____ ____。
(4) 能发生反应生成一种含五元环的化合物,请书写化学反应方程式_______。
能发生反应生成一种含五元环的化合物,请书写化学反应方程式_______。
(1)写出实验室制乙烯的化学方程式______________________.
(2)该实验需加入碎瓷片目的是______________________.
(3)下列实验操作正确的是______________________.
| A.配制乙醇与浓硫酸的混合液时,将1体积乙醇沿烧杯器壁缓缓注入3体积的浓硫酸中,并用玻璃棒不断搅拌 |
| B.加热混合液时,应小心加热使温度缓缓上升至所需温度 |
| C.温度计水银球的位置应伸入液面之下,而不是液面之上 |
| D.收集乙烯气体时应用排水法收集,不能用排空气法收集 |
(4)写出加热条件下溴乙烷与NaOH的水溶液反应的化学方程式:______________________.
(1)纯净物根据其组成和性质可进行如下分类:
上图所示的分类方法属于 (填序号)
A.交叉分类法 B.树状分类法
下列2组物质中均有一种物质的类别与其它2种不同
A.CaO、Na2O、SiO2 B.Al(OH)3、KOH、Ba(OH)2
以上两组物质中,每组里与别的两物质的类别明显不同的物质依次是(填化学式) ; 。
写出能用离子方程式CO32- + 2H+="=" CO2↑+H2O表示的一个化学反应方程式: 。
(2)下图为实验室制取氨的实验装置。
①写出A中所发生反应的化学方程式 。
②该装置还可以制备哪些气体________。
③在收集氨时试管口棉花团的作用是 。
④收集氨气应使用___法,要得到干燥的氨气可选用___作干燥剂,检验集满的方法是 。
在Cl2、NO、SO2、NO2、NH3五种气体中,与空气相遇能立即变色的是_________;
常用于自来水杀菌、消毒的是________;能用向下排空气法收集的是__________;溶于水后能生成强酸的是_________。
(8分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图: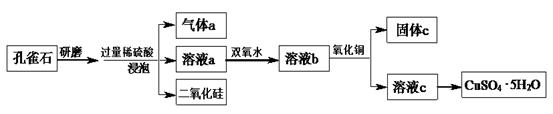
请回答下列问题:
(1)研磨孔雀石的目的是 。
(2)加入双氧水的目的是将溶液中的Fe2+转化为Fe3+,相应的离子方程式为 。
(3)固体c中主要成分的化学式为 。加入氧化铜的作用是 。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸浸出钴的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________;___________________________。