高纯度锰酸锂(LiMn2O4)是锂电池重要的正极材料。
(1)工业上有一种制取高纯度锰酸锂的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生的化学反应方程式:________。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750 ℃共热5 h,得到锰酸锂。请写出发生的化学反应方程式:_________。
(2)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。
把分析纯碳酸锂与球形二氧化锰两种粉末,按物质的量1:4混合均匀加热。
①升温到515 ℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723 ℃)低得多。原因是________。
②升温到566 ℃时,产生另一种气体X,X恰好与CO2物质的量相等,同时得到固体B。请写出发生的化学反应方程式:_________。
③升温到720 ℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出发生的化学反应方程式:_________。
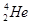 、
、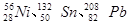 等尤为稳定。根据此信息回答下列问题:(每空1分)
等尤为稳定。根据此信息回答下列问题:(每空1分)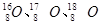 三种同位素,根据上述幻数规律,氧的同位素中原子核最稳定的是;
三种同位素,根据上述幻数规律,氧的同位素中原子核最稳定的是;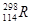 位于元素周期表的第周期族,核稳定性
位于元素周期表的第周期族,核稳定性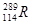 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号