安徽省合肥市高三第二次教学质量检测理综化学试卷
C60可用作储存氢气的材料,结构如图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
| A.C60、Si60、N60都属于原子晶体 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
C.由于 键能小于 键能小于 ,故N60的稳定性弱于N2 ,故N60的稳定性弱于N2 |
D.由于 键长小于 键长小于 键,所以C60熔沸点低于Si60 键,所以C60熔沸点低于Si60 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D.c(H+)/c(OH-)=1×10-13的溶液K+、Na+、CH3COO-,Br- |
下列各反应对应的离子方程式正确的是
| A.向Ca(OH)2溶液中加入过量的NaHCO3溶液Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B.向100 mL 0.12 mol/L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH-+2CO2=HCO3-+BaCO3↓+H2O |
| C.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.向含0.1mol/LNaOH和0.1mol/LNa2CO3的溶液中加入1L0.4mol/L稀盐酸OH-+CO32-+3H+=CO2↑+2H2O |
用酸性氢氧燃料电池电解苦卤水(含Cl—、Br—、Na+、Mg2+)的装置如下图所示(a、b为石墨电极),下列说法正确的是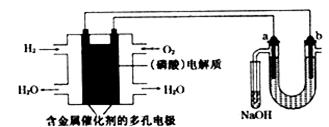
| A.电池工作时,正极反应式为O2+2H2O+4e-=4OH- |
| B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C.试管中NaOH溶液是用来吸收电解时产生的Cl2 |
| D.当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.02mol气体 |
在某容积一定的密闭容器中,有下列可逆反应2A(g) + B(g) xC(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中正确的是
xC(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中正确的是
| A.x=2 | B.该反应是吸热反应 |
| C.P3>P4,y轴表示B的转化率 | D.P3<P4,y轴表示混合气体的密度 |
室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是
A.实验①反应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.实验①反应的溶液中:c(OH-)= c(Na+)-c(A-)=Kw/(1×10-9)mol/L
C.实验②反应的溶液中:c(A-)+c(HA)>0.1mol/L
D.实验②反应的溶液中:c(Na+)= c(A-)> c(OH-)=c(H+)
X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的 键与
键与 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) ∆H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g)∆H=-196.46KJ/mol
③H2(g)+ O2(g)= H2O(l) ∆H=" -285.84" KJ/mol
O2(g)= H2O(l) ∆H=" -285.84" KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为
某抗抑郁药物有效成分F的合成路线如下:
回答下列问题:OR2 C11H9NO5 --H2O
(1)A的化学名称为 ;D分子中除一CHO外的含氧官能团结构简式为 ;
(2)E的结构简式为 ;反应①的反应类型为 ;
(3)反应B→C的化学方程式为 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为 ;
(4)化合物C中含有苯环的同分异构体有 种,其中苯环上只有一个侧链且能发生银镜反应的有机物结构简式为 。
(5)下列有关F的叙述正确的是 。
a.分子式为C11H10O3N
b.既能与盐酸反应生成盐,也能在NaOH反应生成盐
c.1molF最多可以与2molH2反生加成反应
d.既能发生加扰反应也能发生取代反应
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下: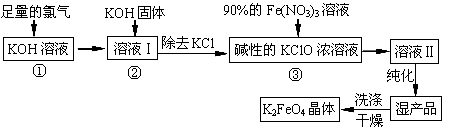
回答下列问题:
(1)反应①应在温度较低时进行,这是由于Cl2与KOH溶液在温度较高时反应生成KClO3,写出加热时该反应的化学方程式 。
(2)在溶液I中加入KOH固体的目的是 (填字母)。
| A.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,同时得到副产品 (写化学式);判断K2FeO4晶体已经洗涤干净的方法是
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,请写出该反应的离子方程式:
(5)若消耗90%的硝酸铁溶液268.9g,则理论上可制得K2FeO4晶体 g
硫代硫酸钠是一种常见的化工原料,将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是 。
(2)用该方法获得的Na2S2O3∙5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究。
【提出假设】该晶体中含有的杂质可能是:Na2CO3、Na2SO3、_____、_____等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为 。
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:______________
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3mol/LH2SO4、1mol/LNaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知:2 Na2S2O3∙+I2=2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L 的碘水进行多次取样滴定,测得Na2S2O3∙5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号