Ⅰ.工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2反应生成 CH4和H2O的热化学方程式 。
已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
Ⅱ.电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: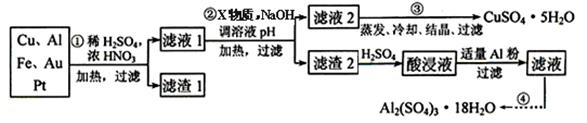
按要求回答下列问题:
(1)滤渣1中存在的金属有____________。
(2)已知沉淀物的pH如下表:
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.7 |
| Cu2+ |
4.9 |
6.7 |
| Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:________________
(4)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在 (填仪器名称)中加热脱水。
(5)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
该电池放电时负极反应式为 ,每有1mol K2FeO4被还原,转移电子的物质的量为 ,充电时阳极反应式为 。
 2SO3,并达到平衡。则(填>、=、<;向左、向右、不移动;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;向左、向右、不移动;增大、减小、不变)。

 2C(g) △H<0,反应达到平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) △H<0,反应达到平衡后测得平衡常数为K,此时A的转化率为x。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号