广东省韶关市高三调研考试理综化学试卷
化学与生产、生活密切相关。下列叙述正确的是
| A.合金材料中不可能含有非金属元素 |
| B.信息产业中的光缆的主要成分是单质硅 |
| C.采用催化措施,将汽车尾气中的CO和NO转化为无害气体 |
| D.14C可用于文物年代的鉴定,14C与12C互为同素异形体 |
设NA为阿佛加德罗常数的数值,下列说法正确的是(相对原子质量:Na=23 Fe="56" H=1 C=12 O="16" )
| A.1 mol Na2O2固体中含离子总数为3NA |
| B.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
| C.40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L |
| D.标准状况下,11.2 L苯中含有分子的数目为0.5NA |
下列条件下可能大量共存的离子组是
| A.某无色溶液中:NH4+、Na+、Cl-、MnO4- |
| B.常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、SO32-、CO32- |
| C.在c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在pH=1的溶液中:K+、Mg2+ SiO32- SO42- |
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出Na2CO3晶体 |
| C |
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 |
HX放出的氢气多且反应速率快 |
HX酸性比HY弱 |
| D |
先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 |
开始有白色沉淀生成;后又有黑色沉淀生成 |
Ksp(ZnS)<Ksp(CuS) |
下列叙述中正确的是
| A.糖类不一定都是高分子化合物,但水解产物相同 |
| B.甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 |
| C.利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 |
| D.甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.0.1mol/L的NaHCO3溶液中:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.最高价氧化物对应水化物的碱性:C>D
C.化合物AE与CE具有不同类型的化学键
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
用下列装置图进行相应的实验,其中正确的是
| A.用图1可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图2装置收集一瓶纯净的NO |
| C.用图3装置中U型管两端有液面差且保持不变时证明装置不漏气 |
| D.用图4检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
苯乙醛( )主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料。现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90。
)主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料。现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90。
已知: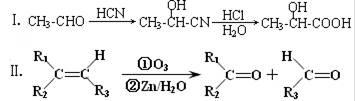
(1)苯乙醛的分子式为____________;B中具有的官能团有(填名称)_______________。
(2)写出B转化为C反应的化学方程式 ;该反应类型属 反应。
(3)C与H2发生加成反应,1molC最多可消耗H2__________mol。
(4)E可能具有的化学性质有(填序号)___________。
①能与H2发生加成反应
②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应
④能与Ag(NH3)2OH溶液发生银镜反应
(5)B的同分异构体有多种,其中符合下列要求的有机物有________种;请写出其中一种同分异构体的结构简式 。
①与B具有相同的官能团种类
②遇三氯化铁溶液不显色
③苯环上的一氯代物只有两种
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义。如硫化氢可经过一系列反应制得硫酸: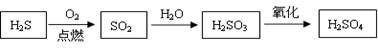
(1)物质发生不完全燃烧时的反应热难以通过实验测得。已知硫化氢气体的燃烧热是586 kJ/mol,固体硫单质的燃烧热是297kJ·mol-1。写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式 。
(2)工业生产中硫化氢尾气可用NaOH溶液吸收。
①吸收尾气后得到的Na2S溶液显 性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)_________。
| A.H2S+OH—=HS—+H2O | B.HS—+H2O=H2S+OH— |
C.HS—+H2O S2—+H3O+ S2—+H3O+ |
D.S2—+H2O H2S+2OH— H2S+2OH— |
(3)在一定温度下,某容器中发生2H2S(g) 2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
 时间 时间物质 |
0 min |
20 min |
60 min |
90 min |
120 min |
| H2S |
|
|
0.006 |
0.005 |
|
| H2 |
0 |
0.002 |
0.004 |
|
|
| S2 |
0 |
|
0.002 |
|
0.0025 |
①判断90 min时反应速率v(正)______v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=______ ___。
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为_________ ____。
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图。
镁橄榄石主要成分是Mg2SiO4,电解法促进镁橄榄石固定CO2的工艺流程如下图所示:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
固碳时主要反应的方程式为NaOH(aq)+CO2(g)=NaHCO3(aq)。
(1)上图方框里的操作名称是 ,横线上的物质有(填化学式) 。
(2)下列物质中也可用作“固碳”的是(填字母序号) 。
| A.CaCl2 | B.NH3·H2O |
| C.Na2CO3 | D.H2O |
(3)由下图可知,90 ℃后曲线A溶解效率下降,分析其原因 。
(4)经分析,所得碱式碳酸镁沉淀中含有少量NaCl。为提纯,可采取的方法是 。本流程中可循环利用的物质是(填化学式) 。
(5)另一种橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。(相对原子质量:C=12 O=16 Ca=40)
【方案Ⅰ】如图:
①称取碳酸钙样品m g;
②加入过量盐酸;
③测定仪器A的增重为a g。
(1)仪器A的名称是____________。
【方案Ⅱ】
①称取碳酸钙样品5.0 g;
②用1.00 mol/L盐酸100.0 mL(过量)溶解样品;
③取溶解后溶液体积的1/10 用0.1000mol/L NaOH溶液滴定,重复滴定三次,平均用去15.00mL。
(2)该碳酸钙样品的纯度= 。(计算结果保留三位有效数字)
【方案Ⅲ】
①称取碳酸钙样品mg;
②高温煅烧1000 ℃直至质量不再改变,冷却后称量,固体质量为m’g。
(3)本方案中的“冷却”应在干燥器中进行,理由是 。
【方案Ⅳ】
①称量碳酸钙样品m g;
②加入足量c mol/L盐酸V mL使之完全溶解;
③过滤并取滤液;
④在滤液中加入过量c ’mol/LNa2CO3溶液V’ mL;
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为b g。
(4)此方案中不需要的数据是(填字母序号) 。
| A.m | B.c、V | C.c’、V’ | D.b |
(5)综上所述,你认为四个方案中,最好的方案是 。写出其它一个方案的缺点:(如:方案Ⅳ;沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。)
方案 ; 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号