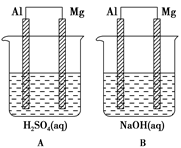
【改编】(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:

①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,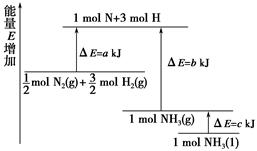
 mol N2(g)和
mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。