回答下列问题:
(1)用乙炔制备聚氯乙烯(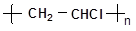 )(自行选择无机原料),
)(自行选择无机原料),
请书写化学反应方程式:_____ __;____ ____。
(2实验室用乙醇制乙烯的反应方程式为________。其反应类型为________。检验生成的乙烯要将导管先后通入______、_________。(填试剂名称)
(3)由溴乙烷为原料合成1,2-二溴乙烷(自行选择无机原料),
请书写化学反应方程式:____ ___;____ ____。
(4) 能发生反应生成一种含五元环的化合物,请书写化学反应方程式_______。
能发生反应生成一种含五元环的化合物,请书写化学反应方程式_______。
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
操作Ⅱ发生反应的离子方程式为____________________;
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为_________________。
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:
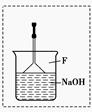
下表为苯、溴和溴苯的相关数据:
| |
苯 |
溴 |
溴苯 |
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
回答下列问题:
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是________(填编号)。
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据________(填“C1”或“C2”)所显示的温度,其温度应为__________________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有___________(填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案________(填“合理”或“不合理”),理由是___________________________。
氯化硫酰(SO2Cl2)是一种无色液体,遇水剧烈水解,其熔点为-54.1 ℃,沸点为69.1 ℃,可用作氯化剂及锂电池正极活性物质。氯化硫酰可用下列反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3 kJ/mol。
SO2Cl2(l) △H=-97.3 kJ/mol。
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写): 。
a.缩小容器体积 b.使用催化剂 c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为: 。
(3)某同学设计了下图所示装置制取氯化硫酰:
①有关该装置的说法正确的是(用字母编号填写): 。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是: 。
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为______,分离产物的方法是: 。
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:_______________________。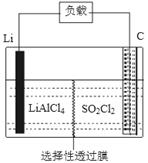
(12分)高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下: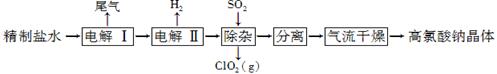
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是____________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有________(填化学式)。“电解Ⅱ”的化学方程式为__________________________________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为______________。
“气流干燥”时,温度控制在80~100 ℃的原因是________________________。
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
(1)写出实验室制乙烯的化学方程式______________________.
(2)该实验需加入碎瓷片目的是______________________.
(3)下列实验操作正确的是______________________.
| A.配制乙醇与浓硫酸的混合液时,将1体积乙醇沿烧杯器壁缓缓注入3体积的浓硫酸中,并用玻璃棒不断搅拌 |
| B.加热混合液时,应小心加热使温度缓缓上升至所需温度 |
| C.温度计水银球的位置应伸入液面之下,而不是液面之上 |
| D.收集乙烯气体时应用排水法收集,不能用排空气法收集 |
(4)写出加热条件下溴乙烷与NaOH的水溶液反应的化学方程式:______________________.
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: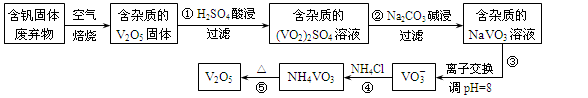
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有 。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。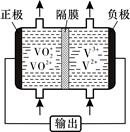
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO+2+H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
(1)1mol焦炭在过程Ⅰ中失去 mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为 。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为 。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s) Si(S)+2ZnCl2(g) △H<0下列说法正确的是( )
Si(S)+2ZnCl2(g) △H<0下列说法正确的是( )
| A.还原过程需在无氧的气氛中进行 |
| B.投入1molZn可生成14g还原产物 |
| C.增加SiCl4(g)的量,该反应平衡常数不变 |
| D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp= (两位有效数字)。
连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?______________________________(填一注意事项)。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
①步骤I中SO2表现了____________(填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________.
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3===____Na2S2O4↓+___H2O+_________
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。___________________ _________.
七铝十二钙(12·7
)是新型的超导材料和发光材料,用白云石(主要含
和
)和废
片制备七铝十二钙的工艺如下:

(1)煅粉主要含和,用适量的
溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中
(
)小于5×10-6
,则溶液
大于(
的
=5×10-12);该工艺中不能用
代替
,原因是。
(2)滤液I中的阴离子有(忽略杂质成分的影响);若滤液I中仅通入,会生成,从而导致
产率降低。
(3)用溶液可除去废
片表面的氧化膜,反应的离子方程式为。
(4)电解制备时,电极分别为
片和石墨,电解总反应方程式为。
(5)一种可超快充电的新型铝电池,充放电时和
两种离子在
电极上相互转化,其它离子不参与电极反应,放电时负极
的电极反应式为。
[化学——选修2:化学与技术](15分)最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下: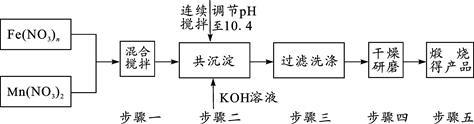
(1)原料Fe(NO3)n中n=____,投入原料Fe(NO3)n和Mn(NO3)2的质量之比应为______。
(2)步骤二中“连续搅拌”的目的是___________________________________________;
步骤三中洗涤干净的标准_____________________________________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为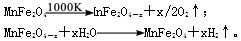
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
②该热化学循环新氢法的优点有____________________________(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是_____________。
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的固体产物具有两性。
(1)若稀硝酸腐蚀锌板产生的气体N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式 。
(2)在操作①中保持pH=8的目的是 。
(3)沉淀I的主要成分是 。
(4)操作③中加热、煮沸的目的是 ;
此步骤操作的理论依据是 。
(5)操作④保持pH=2的目的是 ;
此步骤操作中所用的仪器有带铁圈铁架台、酒精灯、 、 。
(8分)KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是__________ __________;
②所配制KMnO4标准溶液的物质的量浓度为_______________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____(填“偏高”或“偏低”)。
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果 (填“偏大”、“偏小”、或“不变”)。
(2)从石油中分离出汽油、煤油和柴油等,所采用的方法是__________(填“干馏”或“分馏”)。
(3)除去二氧化碳气体中的氯化氢杂质,选用的试剂是_______ __(填“NaOH溶液”或“饱和NaHCO3溶液”)。
(4)下图是实验室制取氨气的装置,回答下列问题:
①收集氨气的方法是 排空气法。
②验证氨气是否收集满的方法是 (写一种)。
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂。其部分工业流程如下:
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得的物质。则步骤Ⅱ中反应的离子方程式是______________________________。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_____________________________。
(3)最后一个步骤中,用“热水洗涤”的目的是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________。
②电解后,LiOH溶液浓度增大的原因_____,b中,生成Li2CO3反应的化学方程式是_______。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。