福建省龙岩市高三5月教学质量检查理综化学试卷
下列过程属于物理变化的是
| A.平行光照射胶体产生丁达尔现象 | B.紫外线照射下,液态蛋白质凝固 |
| C.电解质溶液导电过程 | D.铁遇到冷的浓硝酸溶液发生钝化 |
仅使用酸性高锰酸钾溶液,无法鉴别的物质组是
| A.Na2S和AlCl3 | B.乙烷与乙烯 | C.直馏汽油与苯 | D.CO2与SO2 |
下列物质的性质与应用对应关系不正确的是
| A.亚硫酸钠有还原性,可用作脱氧剂 | B.FeCl3有氧化性,可用于制印刷电路 |
| C.铝有还原性,可冶炼某些金属 | D.浓硫酸有吸水性,可用于干燥氨气 |
下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是
| A.溶液中存在CO32- | B.溶液中c(Na+)>c(CO32-) |
| C.与等物质的量的NaOH恰好中和 | D.溶液中c(H+)·c(OH-)=10-14 |
溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象。

下列说法错误的是
| A.制备溴苯的反应属于取代反应 |
| B.白雾出现是因为HBr易挥发且极易溶于水 |
| C.装置图中长直玻璃导管仅起导气作用 |
| D.溴苯中溶有少量的溴,可用NaOH溶液洗涤除去 |
向H2O2溶液中加入适量稀硫酸酸化的硫酸亚铁溶液,依次观察到如下现象:①反应刚开始,仅有少量气泡产生;②反应片刻后,有大量气泡产生;③试管底部最终出现红褐色沉淀。下列判断正确的是
| A.①中仅发生一个反应 | B.Fe3+能催化H2O2的分解 |
| C.反应过程中溶液pH不断减小 | D.FeSO4与等物质的量的H2O2恰好反应 |
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
CH4(g)+ H2O(g)  CO(g) + 3H2(g)
CO(g) + 3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示。下列说法正确的是
| A.相同条件下,催化剂Ⅱ催化效率更高 |
| B.b点表示上述反应在对应条件下的平衡状态 |
| C.根据图象,无法判断该反应是否为吸热反应 |
| D.该反应平衡常数表达式为K=c(CO)·c3(H2) /c(CH4) |
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系。根据要求回答问题:
(1)上图三个反应中,属于氧化还原反应的有 个。
(2)若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有 。
A.还原性:H2R>H2O B.酸性:H2R>H2O
C.稳定性:H2R<H2O D.沸点:H2R<H2O
(3)若化合物B常温下为气体,其水溶液呈碱性(答题必须用具体物质表示)。
①化合物B的电子式为______;其水溶液呈碱性的原因是 (用离子方程式表示)。
②化合物B可与O2组成燃料电池(氢氧化钾溶液为电解质溶液),其反应产物与反应Ⅲ相同。写出该电池负极的电极反应式______________________。
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,则反应Ⅰ的热化学方程式为______________(注:反应条件相同、所有物质均为气体)。
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
某兴趣小组依据CO2+2Mg=2MgO+C,推测Mg与SO2在隔绝空气条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验Ⅰ 按下图所示进行实验。
(1)实验前需除去镁条表面氧化膜。用简易的物理方法除氧化膜的操作是 ;
(2)实验室制取二氧化硫的化学方程式为 ;
(3)上述装置存在不合理之处,请提出1项改进建议 ;
(4)实验时,先通入SO2直到 现象出现后,再点燃酒精灯;此操作目的是 。
实验Ⅱ 确定固体M的成分。
实验装置如图所示。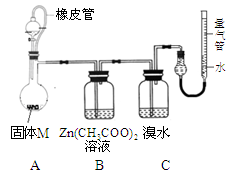
将分液漏斗中稀硫酸(足量)
加入到烧瓶中,完全反应后,实验现象如下:
| 装置 |
A |
B |
C |
量气管 |
| 现象 |
有残留 固体 |
产生白色ZnS沉淀 |
溴水 未褪色 |
进入气体 v mL(标况) |
(5)实验时,B装置中反应的化学方程式为 ;
(6)已知镁的相对原子质量为24,则固体M中金属镁的质量为 g;实验前装置内有空气,对金属镁质量的测定结果的影响是 (填偏低、偏高、无影响);
(7)依以上实验,可确定固体M的成分有 种(填数字)。
【物质结构与性质】
Fe、C、N、O、H可以组成多种物质。回答以下问题:
(1)基态铁原子中,未成对电子数有 个。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],其结构如图。已知CO分子与N2分子结构相似,分子中C、O原子均能提供孤电子对形成配位键。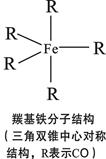
①CO分子中σ键与π键数目之比为 ;
②从电负性角度分析,Fe(CO)5中与Fe形成配位键的是 (填“碳”或“氧”)原子。
③与羰基铁分子的极性相似的分子是 。
A.SO2 B.CS2 C.BF3 D.PCl3
(3)CH4、H2O分子的键角分别为a、b。则a b(填>、=或<),原因是 。
(4)血红素分子结构如图所示。
①血红素分子间存在的作用力有 (填名称);
②与Fe通过配位键结合的氮原子的编号是 。
【有机化学基础】已知:芳香烃A的苯环上只有一个取代基,B、C分子式均为C8H9Cl。它们有如下的转化关系(无机物已略去):
根据要求回答问题:
(1)A的结构简式 。
(2)D转化成F的反应的类型 。
(3)B、C在一定条件下加热可以生成同一种有机物M(能发生加聚反应)。
①一定条件是指 ;
②以M为单体合成高分子化合物的化学反应方程式为 。
(4)H与E反应生成I的方程式为 。
(5)写出符合下列条件的H的同分异构体的结构简式(任写2种): 。
①不能与FeCl3溶液作用显紫色;
②能发生银镜反应;
③苯环上的一卤代物有2种。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号