下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上图表示的序号表示配制溶液的正确操作顺序_____________。
(2)图②中,有一种塑料仪器,其名称是_________。
(3)(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为_____。
(4)根据计算需要量取水的体积是________(水的密度为1g/mL)。量取读数时,下图视线角度正确的是_____。(选填字母标号)
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数________(填“大于”、“小于”或“等于”)10%。
如图是A、B固体物质的溶解度曲线
(1)在 时两种物质的溶解度相同
(2)t1℃时分别将两种物质等质量的饱和溶液降温到0℃,溶液中溶质的质量分数是A B(填“大于”“小于”“等于”)。
(3)t2℃时向70g甲物质中加入100g水,充分溶解后,所得溶液 (填“是”“不是”)饱和溶液,该溶液的溶质的质量是 。
根据图中
、
、
三种固体物质的溶解度曲线,回答下列问题:

(1)
℃,
的物质的溶解度为。
(2)
℃时,将接近饱和的
物质的变成该物质的饱和溶液,可采用(任填一种方法即可)。
(3)
℃时.将
、
、
三种物质的饱和溶液,分别降溫至
℃时,所得溶液中溶质质置分数的大小关系是.
| A. |
|
B. |
|
C. |
|
请用所化学知识解释下列现象或原理。
(1)“南水北调”工程,跨越半个多世纪的调水梦于2014年12月12日正式通水,该工程的开通重组了中国水资源格局,方便了1.1亿人。有些村庄打深井取用地下水,食用前可用 区分地下水是软水还是硬水,常用 的方法来降低水的硬度,以防止结石病的发生。
(2)“釜底抽薪”涉及的化学原理是 。
(3)有NaOH溶液,NaCl溶液,稀硫酸三种物质,用一种试剂就能将他们鉴别出来,该试剂是 。
(4)在检查胃部疾病之前,医生常让病人饮用一种含有硫酸钡的白色牛奶状液体,形象的称作“钡餐”,“钡餐”中的主要物质是硫酸钡,而不能用碳酸钡,其原因可用化学方程式解释为 。
(5)合成材料的应用和发展,大大方便了人类的生活,但是废弃塑料带来的“白色污染”也很严重,为了解决这个问题,我们可以采取的措施有 (答一条即可)。
(6)在生产生活中水是最常用的溶剂,实验室用蔗糖配制一定溶质质量分数的溶液时,可能涉及以下操作:
①上图操作中有错误的是 (填序号)。
②改正错误后,表示正确的操作顺序是 (填序号)。
| A.⑤②①③④ | B.⑤①②③④ | C.⑤③②④① | D.⑤③①④② |
3%的硼酸溶液可用于清洗皮肤的小面积创伤。现配制300g质量分数为3%的硼酸溶液,实验操作如下:
(1)称量硼酸固体的质量:在下图中分别标出所选砝码的质量和游码的示数。
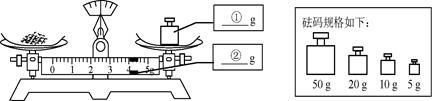
(2)量取水的体积:用量筒取 mL水( )。
)。
(3)溶解:用到的玻璃仪器是 。
(4)装瓶、贴标签:在右图的标签中填上相应的内容 。
如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:
(1) ℃时,A、B两种物质的溶解度相等。
(2)t2℃时,向70gA物质中加入100g水,充分溶解后,所得溶液 (填“是”或“不是”)饱和溶液,该溶液的溶质质量分数是 ;
(3)用一定的方法,将某温度下C的不饱和溶液变为饱和溶液,下列说法正确的是 。
a.溶剂的质量可能不变
b.溶质质量分数一定变大
c.溶液的质量可能不变
d.溶质的质量一定变大
如图为甲、乙两种物质的溶解度曲线,请回答下列问题。
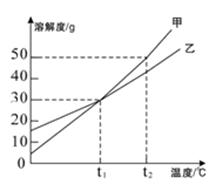
(1)t1℃时,甲物质的溶解度(填">"、"="或"<")乙物质的溶解度。
(2)t2℃时,把50g乙物质放入100g水中,充分搅拌得到的是(填"饱和"或"不饱和")溶液。
(3)t2℃时,有一接近饱和的甲溶液,可采用的方法使它变为该温度下的饱和溶液。
下图是一瓶医用注射盐水标签的部分内容。完成下列填空:
(1)氯化钠中钠、氯元素的质量比是 ;
(2)氯化钠中钠元素的质量分数是 (精确到0.1%);
(3)该瓶盐水能给病人提供氯化钠的质量是 g;
(4)该瓶盐水能给病人提供钠元素的质量是 g(精确到0.1g) 。
下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图:

(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)下列错误操作可能导致溶液溶质的质量分数小于7.5%的是_____________(填序号)
| A.②操作中食盐与砝码放置颠倒; |
| B.①操作中有固体洒落; |
| C.⑤操作中有水溅出; |
| D.读取量筒内液体体积于视线过低; |
E、装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数 (填“偏大”“偏小”“不受影响”)
宏观和微观相联系是化学独特的思维方式。
(1)微观探析化学反应的规律是化学科学的核心任务。根据下列微观示意图回答问题:

①从微粒的角度说明图A反应的实质是 ;
②图B所示反应中,参加反应的微粒是 (写出微粒的符号)。
(2)化学上有一种能将微观粒子数目与宏观物质质量联系起来的量,叫物质的量,其单位是摩尔。1摩尔任何物质中含有构成它的微粒个数都是6.02×10 23个,1摩尔任何物质的质量是以克为单位,数值上都等于该物质的化学式量。例如1摩尔水的各种量关系如图:

①1摩尔水中氢原子数目是 个;②1摩尔水中氧元素质量为 g。
某化学兴趣小组进行了“配制100g20%的氯化钠溶液”的实验。该实验的部分操作如下图所示。

(1)配制此氯化钠溶液的步骤为 、 、溶解。配制过程中用到的仪器有 、 、天平、量筒、药匙和胶头滴管。
(2)需要称取氯化钠的质量是_________g,称量时操作A出现了右盘低的现象,接下来的操作应该是________。(填序号)
① 右边的平衡螺丝向左调 ②右边的平衡螺丝向右调 ③右盘中减少砝码 ④左盘中增加食盐
(3)B中仪器a的名称是_________。量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_______________(填“偏大”或“偏小”)
(4)C中用玻璃棒的作用是________________________。
小敏同学用氢氧化钠固体配制100g 10%的氢氧化钠溶液,她应先用托盘天平称取 g氢氧化钠固体,再用量筒量取 mL水,在烧杯中进行溶解.在此实验中,小敏称取氢氧化钠时不能直接放在托盘上称,应该放在 称.实验过程中所用到的玻璃仪器,除上述提到的以外,还需要的玻璃仪器有 .芳同学发现小敏同学在量水读数时仰视凹液面的最低处,则她配制的氢氧化钠溶液质量分数 于10%.
如图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为_________g.稀释浓H2SO4时,要将_________慢慢沿___________慢慢注入___________中,并 .如果不慎浓硫酸沾到衣服上或手上,应立即用大量 冲洗,然后涂上 。量取浓硫酸时仰视读数,会导致结果 (偏大、偏小)。

实验室用已配置好的质量分数为6%的氯化钠溶液(密度约为
),配制50g质量分数为3%的氯化钠溶液.
(1)配制步骤为:计算、、混匀。
(2)需要6%的氯化钠溶液mL。(结果取整数)
(3)某同学在量取6%的氯化钠溶液体积时俯视读数,则实际配制溶液的溶质质量分数将(填"偏大"、"偏小"或"不变").
(8分)钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加适量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是___________(填字母)。加Na2CO3溶液的作用是除去________。
用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有:
②如果配制后溶液溶质的质量分数低于0. 9%,你认为可能的原因是 (写一个即可)
(2)海水制镁。从海水中提取金属镁的过程如下图所示:
在上述转化过程中发生中和反应的方程式是 ________________ 。海水中本身就含有氯化镁,则①、②两步的作用是_______________
(3)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 _____